
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol可知,若将1mol CH3COOH的稀溶液与含1mol NaOH的稀溶液混合,放出的热量小于57.3kJ | |
| C. | 由C(石墨)═C(金刚石))△H=+1.90/mol可知,金刚石比石墨稳定 | |
| D. | 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ/mol |
分析 A、硫蒸气变化为硫固体为放热过程;
B、醋酸电离时会吸热;
C、物质具有的能量越高越不稳定;
D、2gH2完全燃烧生成液态水,放出285.8kJ热量,则1molH2完全燃烧生成液态水,放出285.8kJ热量.
解答 解:A、硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量硫蒸气多,即前者放出热量多,故A错误;
B、醋酸电离时会吸热,所以1mol CH3COOH的稀溶液与含1mol NaOH的稀溶液混合,放出的热量小于57.3kJ,故B正确;
C、由C(石墨)═C(金刚石))△H=+1.90/mol可知,金刚石的能量高于石墨,物质具有的能量越高越不稳定,所以石墨比金刚石稳定,故C错误;
D、2gH2完全燃烧生成液态水,放出285.8kJ热量,则1molH2完全燃烧生成液态水,放出285.8kJ热量,所以氢气燃烧的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ/mol,故D错误.
故选B.
点评 本题考查了化学反应中的能量变化,题目涉及中和热、物质稳定性与能量的关系、热化学方程式等,属于基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间 浓度(mol?L-1) 温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2,CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下二个反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2,CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下二个反应:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
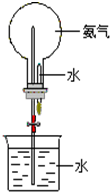 已知氨气与氯化氢气体都是极易溶于水的气体,在标准状况下1升水中最多能溶解500升的氯化氢气体,或者700升的氨气.
已知氨气与氯化氢气体都是极易溶于水的气体,在标准状况下1升水中最多能溶解500升的氯化氢气体,或者700升的氨气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2>I2>Fe3+ | B. | Cl2>Fe3+>I2 | C. | Fe3+>Cl2>I2 | D. | Fe3+>I2>Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:NH4+、Fe2+、SO42-、Cl- | |
| B. | 通入CO2气体的溶液中:Ca2+、I-、ClO-、NO3-、 | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:Na+、I-、SCN-、SO42- | |
| D. | 由水电离出的c(H+)=1.0×10-13 mol•L-1的溶液中:Na+、HCO3-、Cl-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ,B的结构式为
,B的结构式为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com