
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②K (Ni(OH)
(Ni(OH) ): 5.0×10-16 , K
): 5.0×10-16 , K (NiC2O4): 4.0×10-10
(NiC2O4): 4.0×10-10
回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);用pH试纸测定某溶液pH的具体操作是 。
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)沉淀Ⅲ可被电解所得产物 (填化学式)氧化生成Ni(OH)3 ,如何洗涤Ni(OH)3 沉淀 。
【知识点】难溶电解质的溶解平衡 沉淀转化 H5 J1
【答案解析】(1)碳粉
(2)Fe(OH)3、Al(OH)3 ;把干燥pH试纸置于表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取待测液滴在pH试纸上,待显色后立即与标准比色卡比对即可读数。
(3) NiCl2+Na2C2O4==NiC2O4↓+2NaCl
(4) NiC2O4 +2OH-  Ni(OH)2+C2O42- 8.0×105L.mol-1
Ni(OH)2+C2O42- 8.0×105L.mol-1
(5) Cl2 往盛有Ni(OH)3 沉淀的漏斗中注入蒸馏水至浸没沉淀,待水自然流干后,再重复2~3次。
解析:(1)电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成,加入酸只有碳不反应,所以酸溶后所留残渣的主要成份是碳粉;
(2)用NiO调节溶液的pH,溶液pH升高,根据题意知析出沉淀的成分为Fe(OH)3、Al(OH)3 ; 把干燥pH试纸置于表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取待测液滴在pH试纸上,待显色后立即与标准比色卡比对即可读数。
(3)NiCl2可与Na2C2O4反应生成NiC2O4和NaCl:NiCl2+Na2C2O4==NiC2O4↓+2NaCl
(4)根据K (Ni(OH)
(Ni(OH) ): 5.0×10-16 , K
): 5.0×10-16 , K (NiC2O4): 4.0×10-10利用沉淀转化知:NiC2O4 +2OH-
(NiC2O4): 4.0×10-10利用沉淀转化知:NiC2O4 +2OH-  Ni(OH)2+C2O42- ;
Ni(OH)2+C2O42- ;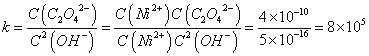
(5)电解滤液1产生氯气,沉淀Ⅲ可被电解所得产物氯气氧化生成Ni(OH)3 ,往盛有Ni(OH)3 沉淀的漏斗中注入蒸馏水至浸没沉淀,待水自然流干后,再重复2~3次。
【思路点拨】本题考查了电化学,化学方程式的书写,离子的检验等知识,看懂实验流程是关键。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
在0.1mol•L﹣1 NH3•H2O溶液中存在如下电离平衡:NH3•H2O⇌NH4++OH﹣.对于该平衡,下列叙述中正确的是( )
|
| A. | 降低温度,溶液中c(NH4+)增大 |
|
| B. | 加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 |
|
| C. | 加入少量0.1 mol•L﹣1 HCl溶液,溶液中c(OH﹣)增大 |
|
| D. | 加入水时,溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图中每一方格表示有关的一种反应物或生成物.A、C为无色气体.

(1)物质M可以是 或 ,C是 ,F是 .
(2)反应①的化学方程式 .
(3)反应②的离子方程式 .
(4)F→G的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数,下列说法正确的是( )
|
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA |
|
| B. | 28g乙烯所含共用电子对数目为4NA |
|
| C. | 1 mol甲基的电子数目为9NA |
|
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
为了比较①H﹣OH,②CH3COOH,③CH3CH2﹣OH,④H2CO3,⑤苯酚五种物质分子中﹣OH上氢原子的活动性顺序,某课外活动小组设计了如下表所示的实验方案.请你利用有关实验仪器及给出的试剂,填写表中的空格,完成上述实验方案.可供选用的试剂有:紫色石蕊试液、金属钠、氢氧化钠溶液、碳酸钠溶液.实验中所需仪器自选.
| 实验步骤和操作 | 实验现象 | 结论(﹣OH上氢原子活动性顺序) |
| (1)五种物质各取少量于五支试管中,各加入紫色石蕊试液2~3滴 | ②④变红,其它不变 | ②、④>①、③、⑤ |
| (2) | ||
| (3)①、③、⑤各取少量于试管中,各加入少量NaOH溶液 | ⑤由浑浊变澄清 | ⑤>①、③ |
| (4) |
(5)通过以上实验比较,从而得出这五种物质分子中﹣OH上氢原子的活动性由强到弱的顺序为 (填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
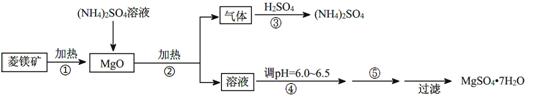 (1)步骤②中发生反应的离子方程式为 。
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)步骤⑤的操作为
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为
[25℃时,Ksp[Mg(OH)2] =5.6×10-12]。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知汽车尾气无害化处理反应为2NO(g)+2CO(g)N2(g)+2CO2(g)。下列说法不正确的是( )
A.升高温度可使该反应的逆反应速率降低
B.使用高效催化剂可有效提高正反应速率
C.反应达到平衡后,NO的反应速率保持恒定
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
下列描述正确的是( )
|
| A. | 摩尔是国际单位制中的一个基本物理量 |
|
| B. | 有单质参加或有单质生成的化学反应都属于氧化还原反应 |
|
| C. | 当光束分别通过氢氧化铁胶体、氯化铁溶液时,都可以从侧面看见光亮的通路 |
|
| D. | 分液时,先将分液漏斗中下层液体放出,然后再将上层液体从上口倒出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com