
| m |
| ρ |
| 49g |
| 98% |
| m |
| ρ |
| 50g |
| 1.84g/cm3 |
| m |
| ρ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
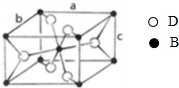 A、B、C、D四种元素的原子序数依次递增,A、B的基态原子中L层未成对电子数分别为3、2,C在短周期主族元素中电负性最小,D元素被称为继铁、铝之后的第三金属,其合金多用于航天工业,被誉为“21世纪的金属”,其基态原子外围电子占据两个能级且各能级电子数相等.请回答下列问题:
A、B、C、D四种元素的原子序数依次递增,A、B的基态原子中L层未成对电子数分别为3、2,C在短周期主族元素中电负性最小,D元素被称为继铁、铝之后的第三金属,其合金多用于航天工业,被誉为“21世纪的金属”,其基态原子外围电子占据两个能级且各能级电子数相等.请回答下列问题:| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+):c(CO32-)=1:1 |
| B、c(Na+):c(CO32-)>2:1 |
| C、c(Na+):c(CO32-)=2:1 |
| D、c(Na+):c(CO32-)<2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com