
| A. | ①⑤ | B. | ①③⑤⑧ | C. | ②④⑥⑦ | D. | ②④⑥ |
分析 ①原子核外电子排布相同的离子,核电核数越大,半径越大,离子的原子核外电子层数越多,半径越大;
②元素的非金属性越强,对应的氢化物越稳定;
③元素的非金属性越强,对应阴离子的还原性越弱;
④元素的非金属性越强,对应单质的氧化性越强;
⑤元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
⑥同周期元素从左到右元素的非金属性逐渐增强,同主族元素从上到下元素的非金属性逐渐减弱;
⑦同周期元素从左到右元素的逐渐减弱,同主族元素从上到下元素的金属性逐渐增强;
⑧含氢键的物质沸点最高,氢化物的相对分子质量越大沸点越大.
解答 解:①K+、S2-、Cl-原子核外电子排布相同,核电核数S2-<Cl-<K+,则半径S2->Cl->K+,离子的原子核外电子层数越多,半径越大,核外电子层数最小,则半径最小,则有S2->Cl->K+>Al3+,故①错误;
②非金属性:F>Cl>S>P>Si,元素的非金属性越强,对应的氢化物越稳定,则氢化物的稳定性:HF>HCl>H2S>PH3>SiH4,故②正确;
③非金属性:Cl>Br>I>S,元素的非金属性越强,对应阴离子的还原性越弱,则还原性:Cl-<Br-<I-<S2-,故③错误;
④非金属性:Cl>S>Se>Te,元素的非金属性越强,对应单质的氧化性越强,则氧化性:Cl2>S>Se>Te,故④正确;
⑤非金属性:Cl>S>P>C,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性HClO4>H2SO4>H3PO4>H2CO3,故⑤错误;
⑥因同周期元素从左到右元素的非金属性逐渐增强,则有O>N、P>Si,同主族元素从上到下元素的非金属性逐渐减弱,则N>P,所以有非金属性:O>N>P>Si,故⑥正确;
⑦同周期元素从左到右元素的逐渐减弱,则金属性Ca<K,同主族元素从上到下元素的金属性逐渐增强,则金属性Be<Mg<Ca,所以金属性:Be<Mg<Ca<K,故⑦正确;
⑧含氢键的物质沸点最高,氢化物的相对分子质量越大沸点越大,则沸点为H2O>H2Se>H2S,故错误;
故选B.
点评 本题考查元素周期表与周期律的递变性,为高频考点,把握元素周期律、元素性质的比较等为解答的关键,学习中注重基础知识的积累,题目难度中等.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
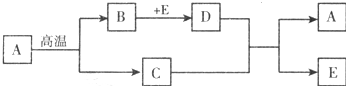
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

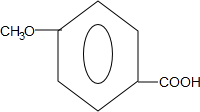 .
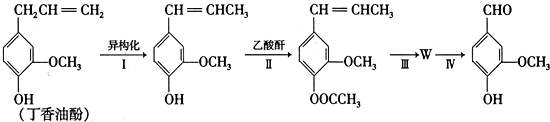
.
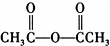 )
) 合成丁香油酚的反应类型为取代反应.
合成丁香油酚的反应类型为取代反应.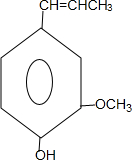 +CH3OCOCOCH3→
+CH3OCOCOCH3→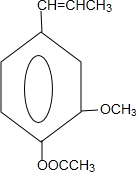 +CH3COOH
+CH3COOH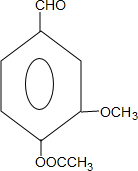 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
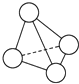 N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )
N4的分子结构类似白磷分子, 它的结构如图所示,已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中正确的是( )| A. | 1 mol N4气体转变为N2将放出775 kJ热量 | |
| B. | 1 mol N4气体转变为N2将放出882 kJ热量 | |
| C. | 1 mol N4气体转变为N2将吸收775 kJ热量 | |
| D. | 1 mol N4气体转变为N2将吸收882 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
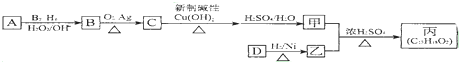
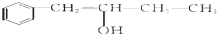
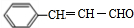
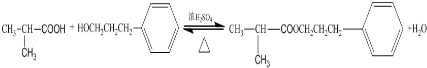 ,该反应类型为酯化反应:
,该反应类型为酯化反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①②④⑥ | C. | ①②③⑤ | D. | 只有⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com