
 已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.
已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表.| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数 |
| Y | 原子核外的L层有3个未成对电子 |
| Z | 地壳中含量最多的元素 |
| Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | N能层上只有一个电子,K、L、M层均排满电子 |
 .X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.
.X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为3:2.分析 已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,X原子的L层上s电子数等于p电子数,则L层含有4个电子,为C元素;Z是地壳中含量最多的元素,则Z为O元素;Y原子核外的L层有3个未成对电子,其原子序数小于O大于C,则Z为N元素;Q的单质常温常压下是气体,原子的M层上有1个未成对的p电子,则M为Cl元素;R的核电荷数是Y与Q的核电荷数之和,则R的核电荷数=7+17=24,为Cr元素;E的N能层上只有一个电子,K、L、M层均排满电子,其核外电子数为2+8+18+1=29,为Cu元素,据此结合元素周期律知识解答(1)~(6);
(7)可以均摊法计算晶胞中Cu原子数目,结合K的摩尔质量计算晶胞质量,Cu的原子半径为d pm,则晶胞棱长为4d cm×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$d cm,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,X原子的L层上s电子数等于p电子数,则L层含有4个电子,为C元素;Z是地壳中含量最多的元素,则Z为O元素;Y原子核外的L层有3个未成对电子,其原子序数小于O大于C,则Z为N元素;Q的单质常温常压下是气体,原子的M层上有1个未成对的p电子,则M为Cl元素;R的核电荷数是Y与Q的核电荷数之和,则R的核电荷数=7+17=24,为Cr元素;E的N能层上只有一个电子,K、L、M层均排满电子,其核外电子数为2+8+18+1=29,为Cu元素,
(1)Y为N元素,其原子序数为7,最外层5个电子,为2s22p3,为2s和2p电子,且2p轨道中应为3个单电子,价电子轨道排布式为: ;
;
X为C元素,C的一种氢化物相对分子质量为26,该化合物为乙炔,乙炔分子中含有3个σ键、2个π键,其分子中的σ键与π键的键数之比为3:2,
故答案为: ; 3:2;
; 3:2;
(2)同周期随原子序数增大,元素第一电离能呈增大强酸,但氮元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:N>O>C,
故答案为:N>O>C;
(3)X、Z元素分别与氢元素形成的最简单化合物分别为CH4、H2O,由于水分子间可以形成氢键,使沸点升高,导致水的沸点较高,
故答案为:H2O; 水分子间可以形成氢键,使沸点升高;
(4)根据等电子体原理,可知化合物CO与N2互为等电子体,氮气分子的结构式为N≡N,则CO的结构式是C≡O,
故答案为:C≡O;
(5)RCl3•6H2O为CrCl3•6H2O,根据题意知,氯化铬(CrCl3•6H2O)和氯化银的物质的量之比是1:2,根据氯离子守恒知,则CrCl3•6H2O化学式中含有2个氯离子为外界离子,剩余的1个氯离子是配原子,所以氯化铬(CrCl3•6H2O)的化学式可能为[Cr(H2O)5Cl]Cl2•H2O,
故答案为:B;
(6)ESO4为CuSO4,向含少量CuSO4的水溶液中逐滴滴入氨水,生成氢氧化铜蓝色沉淀,反应的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;
继续滴加氨水至过量,沉淀溶解生成=[Cu(NH3)4]2+,得到天蓝色溶液,反应的离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,
故答案为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+; Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(7)E为Cu,根据图乙可知,晶胞中Cu原子数目为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为:4×$\frac{M}{{N}_{A}}$g,Cu的原子半径为d cm,则晶胞棱长为:4d cm×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$d cm,故Cu晶胞的密度ρ=$\frac{m}{V}$=$\frac{\frac{4M}{{N}_{A}}g}{(2\sqrt{2}d\\;cm)^{3}}$=$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$g.cm-3,
故答案为:$\frac{M}{4\sqrt{2}{d}^{3}{N}_{A}}$.
点评 本题考查较为综合,涉及晶胞计算、配合物、原子结构与元素周期律应用等知识,题目难度较大,推断元素为解答关键,注意掌握均摊法在晶胞计算中的应用,试题培养了学生的分析、理解能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题
| A. | 3-甲基-1-丁烯的结构简式:(CH3)2CHCH=CH2 | |
| B. | 乙醇分子的比例模型: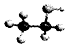 | |
| C. | CF2Cl2有两种同分异构体 | |
| D. | HOCH2COOH缩聚物的结构简式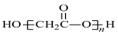 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的质量不再改变 | |
| B. | 氯化氢的转化率不再改变 | |
| C. | 断开4 mol H-Cl键的同时生成4 mol H-O键 | |
| D. | n(HCl):n(O2):n(Cl2):n(H2O)=4:1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3+3H2 $\frac{\underline{\;\;△\;\;}}{\;}$2Al+3H2O | B. | Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2 | ||
| C. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 | D. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
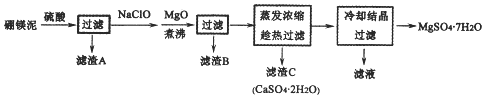
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水鉴别MgCl2溶液和AlCl3溶液 | |
| B. | 用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 | |
| C. | 用AgNO3鉴别Na2CO3溶液和NaCl溶液 | |
| D. | 用足量的盐酸和BaCl2溶液鉴别溶液中是否含SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Mg+SO2$\frac{\underline{\;△\;}}{\;}$2MgO+S | |
| B. | SO2+Br2+2H2O═2HBr+H2SO4 | |
| C. | Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O | |
| D. | SO2+2NaOH═Na2SO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7 g氨气所含分子数为0.1 NA | |
| B. | 常温常压下,11.2 L氯气所含原子数为NA | |
| C. | 1 mol•L-1的BaCl2溶液中所含Cl-离子数目为2 NA | |
| D. | 71 g氯气与足量铁粉充分反应,转移的电子数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 19gNHD2和19gNH2T中含有的中子数均为10NA | |
| B. | 标准状况下,22.4LO2参加反应转移的电子数一定是4NA | |
| C. | 1molCnH2n中含有的共用电子对数为(3n+1)NA | |
| D. | 2molSO2和1molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com