
| A. | 两容器中所含气体分子数一定不同 | |
| B. | 两容器中所含气体的质量一定不同 | |
| C. | Y容器中CH4、O2、N2的质量之比可以为1:6:3 | |
| D. | Y容器中CH4、O2、N2的物质的质量之比一定为1:3:6 |
分析 A.根据PV=nRT,N=nNA分析;
B.根据m=ρV计算;
C、D.根据密度之比等于摩尔质量之比可知,两个容器中气体的平均摩尔质量相同,即CH4、O2、N2的平均摩尔质量为28g/mol,据此计算.
解答 解:A.同温同压下,PV=nRT,两个容器的体积不同,则物质的量不同,所以分子数不同,故A正确;
B.已知两个容器的体积不同,而气体的密度相同,由m=ρV可知,质量不同,故B正确;
C.根据密度之比等于摩尔质量之比可知,两个容器中气体的平均摩尔质量相同,即CH4、O2、N2的平均摩尔质量为28g/mol,由于N2的分子量为28g/mol,则CH4、O2的平均摩尔质量为28g/mol,设CH4的质量为xg,O2的质量为yg,则$\frac{x+y}{\frac{x}{16}+\frac{y}{32}}$=28,所以$\frac{x}{y}$=$\frac{1}{6}$,N2的质量不固定,所以CH4、O2、N2的质量之比可以为1:6:3,故C正确;
D.由C分析可知,Y容器中CH4、O2、N2的物质的质量之比不是1:3:6,故D错误.
故选D.
点评 本题考查了阿伏伽德罗定律,题目难度中等,侧重于考查学生的分析能力和计算能力,注意根据PV=nRT以及密度与摩尔质量之间的关系分析.


科目:高中化学 来源: 题型:解答题
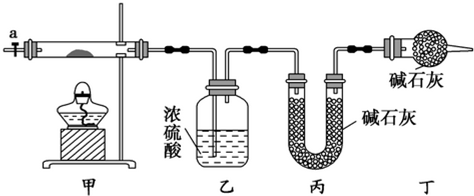

| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
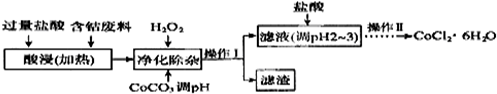
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | CO(OH)2 | Al(OH)2 |
| 开始沉淀(PH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(PH) | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1稀硫酸中含有硫酸根个数为0.1NA | |
| B. | 标准状况下,0.5NA氟化氢分子所占体积是11.2L | |
| C. | 2.4g金属镁与足量的盐酸反应,生成氢气的体积为2.24L | |
| D. | 12.4g白磷中含有磷原子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入适量铜粉除去Cu(NO3)2溶液中的AgNO3杂质 | |
| B. | 用NaOH溶液除去CO2中混有的HCl气体 | |
| C. | 稀释浓硫酸时,应将浓硫酸沿器壁慢慢倒入量筒中的水中 | |
| D. | 用乙醇从碘水中萃取碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子组成相差1个或若干个CH2原子团的物质互称为同系物 | |
| B. | 相对分子质量相同的有机物是同分异构体 | |
| C. | 分子式相同、结构相同的有机物物理性质和化学性质一定相同 | |
| D. | 碳原子之间只以单键相结合的链烃为烷烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将饱和FeCl3溶液滴入沸水中制备胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 用FeS去除废水中的Hg2+:Hg2++S2-═HgS↓ | |
| C. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | KHS溶液中HS-的电离:HS-+H2O?H3O++S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积、等物质的量浓度的强酸中所含的H+数目一定相等 | |
| B. | 1L二氧化碳气体一定比1L氧气的质量大 | |
| C. | 同温同压下,相同体积的物质,它们的物质的量必定相等 | |
| D. | 任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com