

| ���� | Pb2+ | Ca2+ | Fe3+ | Mn2+ |
| ����ǰŨ��/��mg•L-1�� | 0.100 | 29.8 | 0.12 | 0.087 |
| ������Ũ��/��mg•L-1�� | 0.004 | 22.6 | 0.04 | 0.053 |
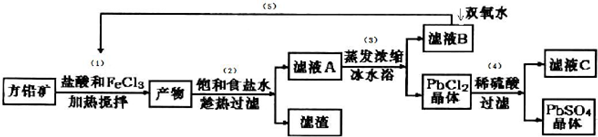
���� ����Ǧ���м���FeCl3��Һ�����ᣬFeCl3��PbS��Ӧ����PbCl2��S�������м��뱥��ʳ��ˮ�����ȹ��ˣ�����PbCl2��s��+2Cl-��aq��?PbCl4-��H��0������У�ʹPbCl2�ܽ⣬���˳�ȥ������ʣ���ҺA����PbCl4-��Cl-��Fe2+��Fe3+�ȣ���ҺA����Ũ������ˮԡ����ȴ������ƽ��������У�����PbCl2���壬��ҺB�к���Fe2+��Fe3+���ù����������������ѭ�����ã�PbCl2�����м���ϡ���ᣬת��Ϊ�����ܵ�����Ǧ���������˵õ�����Ǧ������ϴ�ӡ���ɵõ�����Ǧ��ĩ����ҺC�к���HCl��
������Fe3+��Pb2+������������ʽ��ʼ����ʱ��PHֵ�ֱ�Ϊ1.9��7�����������������ҪĿ�ģ�
FeCl3��PbS��Ӧ����PbCl2��S��PbԪ�ػ��ϼ۲��䣬SԪ�ػ��ϼ����ߣ�����Ԫ�صĻ��ϼ۽��ͣ���FeCl2���ɣ�
�������¶ȶ�ƽ���ƶ���Ӱ����з�����
���������⽫��ҺB��Fe2+����ΪFe3+����ѭ�����ã�C��Һ�к���HCl��Ҳ����ѭ�����ã�
��������pH��13ʱ��Pb��OH��3-Ũ�ȼ�С��Pb��OH��42-Ũ������Pb��OH��3-�����������ӽ��ΪPb��OH��42-��
�ڢ���Pb2+��Fe3+��Ũ��ת���ʽ����жϣ�
�μӷ�Ӧ����Pb2+����ͼ���֪��ѡ��PHҪʹǦȫ����Pb2+��ʽ���ڣ�
��� �⣺����Ǧ���м���FeCl3��Һ�����ᣬFeCl3��PbS��Ӧ����PbCl2��S�������м��뱥��ʳ��ˮ�����ȹ��ˣ�����PbCl2��s��+2Cl-��aq��?PbCl4-��H��0������У�ʹPbCl2�ܽ⣬���˳�ȥ������ʣ���ҺA����PbCl4-��Cl-��Fe2+��Fe3+�ȣ���ҺA����Ũ������ˮԡ����ȴ������ƽ��������У�����PbCl2���壬��ҺB�к���Fe2+��Fe3+���ù����������������ѭ�����ã�PbCl2�����м���ϡ���ᣬת��Ϊ�����ܵ�����Ǧ���������˵õ�����Ǧ������ϴ�ӡ���ɵõ�����Ǧ��ĩ����ҺC�к���HCl��
����Fe3+��Pb2+������������ʽ��ʼ����ʱ��PHֵ�ֱ�Ϊ1.9��7�������м���������Կ�����Һ��pH��1.9����ҪĿ���ǣ�����Fe3+��ˮ�⣬
FeCl3��PbS��Ӧ����PbCl2��S��PbԪ�ػ��ϼ۲��䣬SԪ�ػ��ϼ����ߣ�����Ԫ�صĻ��ϼ۽��ͣ���FeCl2���ɣ���Ӧ����ʽΪ��2FeCl3+PbS=PbCl2+S+2FeCl2����Ӧ���ӷ���ʽΪ��2Fe3++PbS=PbCl2+S+2Fe2+��
�ʴ�Ϊ������Fe3+��ˮ�⣻2Fe3++PbS=PbCl2+S+2Fe2+��
�����ñ�ˮԡʹPbCl2��s��+2Cl-��aq��?PbCl4-��H��0�����ƶ���ʹPbCl4-ת��PbCl2������
�ʴ�Ϊ���ñ�ˮԡʹPbCl2��s��+2Cl-��aq��?PbCl4-��H��0�����ƶ���ʹPbCl4-ת��PbCl2������
���������⽫��ҺB��Fe2+����ΪFe3+����ѭ�����ã�C��Һ�к���HCl��Ҳ����ѭ�����ã�
�ʴ�Ϊ��FeCl3��HCl��
��������pH��13ʱ��Pb��OH��3-Ũ�ȼ�С��Pb��OH��42-Ũ������Pb��OH��3-�����������ӽ��ΪPb��OH��42-����Ӧ���ӷ���ʽΪ��Pb��OH��3-+HO-=Pb��OH��42-��
�ʴ�Ϊ��Pb��OH��3-+HO-=Pb��OH��42-��
�ڢ����Լ���Pb2+��Ũ��ת����Ϊ$\frac{��0.1-0.004��}{0.1}$��1005%=96%��Fe3+��Ũ��ת����Ϊ$\frac{0.12-0.04}{0.12}$��100%=67%������ȥ��Pb2+��Fe3+Ч���ã�
�ʴ�Ϊ�������Լ���Pb2+��Ũ��ת����Ϊ$\frac{��0.1-0.004��}{0.1}$��1005%=96%��Fe3+��Ũ��ת����Ϊ$\frac{0.12-0.04}{0.12}$��100%=67%������ȥ��Pb2+��Fe3+Ч���ã�
��ӦΪ2EH��s��+Pb2+?E2Pb��s��+2H+���μӷ�Ӧ����Pb2+����ͼ���֪��ѡ��PHҪʹǦȫ����Pb2+��ʽ���ڣ�����Ǧʱ����ʵ�pHԼ6��
�ʴ�Ϊ��B��
���� ���⿼�������Ʊ�ʵ�鷽������ȷ�����Ʊ���������Ϊ���ؼ��������ֿ�����ѧ���ķ������������������Ӧ����ѧ֪ʶ���������Ѷ��еȣ�


 53���ò�ϵ�д�
53���ò�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʱ�� �ȶ��� | 0�� | 2�� | 4�� | 6�� | 8�� | 10�� | 12�� | 14�� | 16�� |
| �ȶ���1Ũ�� | 80 | 150 | 80 | 20 | 10 | 5 | 0 | 0 | 0 |
| �ȶ���2Ũ�� | 40 | 52 | 52 | 52 | 52 | 50 | 48 | 47 | 20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ�� |  |  | 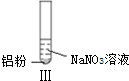 |
| ���� | ��Һ��ɫ���Թ��Ϸ� �ʺ���ɫ | �����������ݣ���ʹʪ��� ɫʯ����ֽ���� | �������ݣ���ʹʪ���ɫʯ����ֽ���� |
| A�� | ʵ����Թ��Ϸ����ֺ���ɫ��ԭ���ǣ�2NO+O2=2NO2 | |
| B�� | ����ʵ���������������˵������NH3���� | |
| C�� | ʵ�����Һ�з����ķ�Ӧ�ǣ�Al+6H++3NO3-=Al3++3NO2��+3H2O | |
| D�� | ��ʵ����У�NO3-���ᡢ�������Һ�ж�����ԭ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO | B�� | NH3 | C�� | Cl2 | D�� | N2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ���ʵ���Ũ����ȵĢ�NH4Cl �ڣ�NH4��2SO4 ��NH4Al��SO4��2������Һ�У�c��NH4+�ɴ�С��˳��Ϊ���ۣ��ڣ��� | |
| B�� | 0.1mol•L-1CH3COOH��0.05mol•L-1NaOH��Һ�������ϣ�pH��7���� c��CH3COO-����c��Na+����cCH3COOH����c��H+�� | |
| C�� | 0.1 mol•L-1Na2CO3��0.05mol•L-1 NaHCO3��Һ�������ϣ� $\frac{3}{5}$c��Na+��=c��CO32-��+c��HCO3-��+c��H2CO3�� | |
| D�� | ��0.1 mol•L-1NaHC2O4��Һ��pH��7���У�c��OH-��+2c��C2O42-��=c��H+��+2c��H2C2O4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ϡ��������������������������������� | |
| B�� | �ɱ������˹����꣬�������˸ɱ��������� | |
| C�� | θҩ�к�������þ����Ϊ������þ�ܸ����ṩþԪ�� | |
| D�� | ̼�����������Ƹ��ķ��ͷ���������̼���������뷢�������е��������ʷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��һ�� | B�� | �ڶ��� | C�� | ������ | D�� | ���ľ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com