
如图所示为常见气体制备、干燥、性质验证和尾气处理的部分仪器装置(加热及固定装置均略去),仪器装置可任意选择,必要时可重复选用。
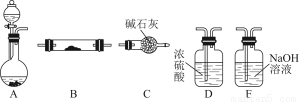
请回答下列问题:
(1)在装置A的圆底烧瓶中装入锌片,分液漏斗中装入稀硫酸,以验证H2的还原性并检验其氧化产物。
①若按顺序A→D→B→B→C连接时,则两次使用的装置B中所盛放药品的化学式依次为CuO、 (填化学式)。
②检验装置的气密性后,在加热装有CuO的装置B前必须进行的操作是 。
(2)在装置A的锥形瓶中装入Na2O2,分液漏斗中装入浓氨水,装置B中装入固体催化剂,以进行氨的催化氧化。
①若装置的连接顺序为A→C→B→C,则装置B中氨的催化氧化反应的化学方程式为 ,装置B中可能观察到的现象是 。
②若把装置A制得的气体与Cl2混合在一起,产生白烟,写出反应的化学方程式 。该反应体现了氨的 性。
(1)①CuSO4 ②检验H2的纯度
(2)①4NH3+5O2 4NO+6H2O 有红棕色气体生成
4NO+6H2O 有红棕色气体生成
②8NH3+3Cl2=N2+6NH4Cl 还原性
【解析】(1)①实验目的为验证H2的还原性并检验其氧化产物,可通过炽热的CuO变红验证氢气的还原性,通过无水硫酸铜变蓝验证H2的氧化产物水;②氢气和空气的混合气体可能发生爆炸,所以氢气在加热前应验纯。(2)①NH3催化氧化产物为NO,常温下即可与O2反应生成红棕色的NO2;②由题意可知反应物为NH3和Cl2,有白烟产生说明生成了固态产物,应为NH4Cl,Cl2被还原,则还原剂应为NH3,在反应中被氧化为N2,根据元素守恒和电子守恒将方程式配平即可。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷A(解析版) 题型:选择题
一定条件下,向某密闭容器中加入一定量的N2和H2发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1,测得0到10 s内,c(H2)减小了0.75 mol·L-1,下列说法正确的是( )
2NH3(g) ΔH=-92.2 kJ·mol-1,测得0到10 s内,c(H2)减小了0.75 mol·L-1,下列说法正确的是( )
A.10 s到15 s内c(NH3)增加量等于0.25 mol·L-1
B.10 s内氨气的平均反应速率为0.025 mol·L-1·s-1
C.达平衡后,分离出少量NH3,v正增大
D.该反应的逆反应的活化能不小于92.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题4离子反应练习卷(解析版) 题型:选择题
下列离子方程式或化学方程式与所述事实相符且正确的是( )
A.H218O中投入Na2O2固体:2H218O+2O22—=4OH-+18O2↑
B.向0.1 mol·L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH- =H2O
C.以金属银为阳极电解饱和硫酸铜溶液:Cu2++2H2O=2Cu+O2↑+4H+
D.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42—完全沉淀:Al3++2SO42—+2Ba2++4OH-=AlO2—+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题16物质结构与性质练习卷(解析版) 题型:填空题
许多金属及它们的化合物在科学研究和工业生产中具有许多用途。
回答下列有关问题:
(1)基态Ni的核外电子排布式为__________________________________________,
第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是________。
(2)配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=________,CO与N2结构相似,CO分子内σ键与π键个数之比为________。
(3)NiO、FeO的晶体结构类型均与氯化钠的相同。
①Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”);
②NiO晶体中Ni的配位数为________。
(4)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是________________________________________________________________________________________________________________________________________________,
反应的离子方程式为________________________________________________________________________。
(5)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为________,若该晶胞的边长为a pm,则合金的密度为________g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题15化学与技术练习卷(解析版) 题型:填空题
银氨溶液放久后会产生叠氮化银(AgN3)而引起爆炸,直接排放会污染环境,且造成银资源的浪费。某研究小组设计了从银镜反应后的废液中(含过量的银氨溶液,假设不含单质银)回收银的如下两种实验流程:
(已知:[Ag(NH3)2]+在溶液中存在平衡:[Ag(NH3)2]+??Ag++2NH3)
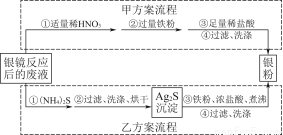
(1)写出甲方案第①步废液与稀HNO3反应的离子方程式 。
(2)甲方案第②步加入的铁粉要过量的目的是 。
甲方案流程可能产生的大气污染物是 。
(3)乙方案若最终得到银粉的质量偏大,排除未洗涤干净的因素,可能的原因是 。
(4)实验室配制银氨溶液的操作过程是 。
(5)已知乙方案第③步反应有H2S气体产生,若最终得到银粉21.6 g,不考虑其他损失,理论上该步需要加入铁粉 g。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题14综合实验与探究练习卷A(解析版) 题型:选择题
用下列装置能达到有关实验目的的是( )
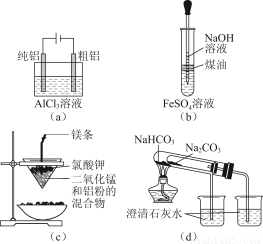
A.用图(a)装置电解精炼铝
B.用图(b)装置制备Fe(OH)2
C.图(c)装置只可制得金属钾
D.图(d)验证NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题12有机物的结构与性质练习卷(解析版) 题型:填空题
某学习小组欲模拟从某工厂废液中回收丙酮、乙醇和乙酸的实验。制定了如下试验流程。
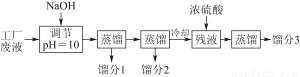
已知该废液中主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。且各种成分的沸点如下表:
物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
沸点(℃) | 56.2 | 77.06 | 78 | 117.9 |
(1)馏分3的成分为____________。
(2)上述流程中调节pH=10的目的是________________________________________________________________________________________________________________________________________________。
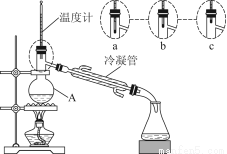
(3)该小组同学的蒸馏装置如图所示。则A中温度计的位置正确的是________(填“a”“b”或“c”)。
(4)国家标准规定,优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30 g/L,总酯量(以乙酸乙酯计)应不少于2.0 g/L。
①为测定某白酒样品的总酸量,取20.00 mL样品于锥形瓶中,加入酚酞指示剂2滴,用0.010 mol/L的NaOH标准溶液滴定至终点。判断终点的依据是________________________________________________________________________________________________________________________________________________。
若该白酒样品为优质级,则消耗NaOH溶液体积应不小于________mL。
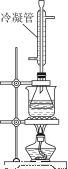
②白酒中的总酯量可用返滴法测定。往上题滴定后的溶液(恰好至终点)中再加入20.00mL0.100mol/L NaOH标准溶液,用图装置水浴加热半小时。冷却后用0.100mol/L的硫酸标准溶液滴定至终点。加热半小时的目的是______________________,冷凝管的作用是______________。已知最终消耗硫酸标准溶液7.70 mL,该白酒样品中总酯量为________g/L(保留小数点后三位数字)。
(5)下列操作会使总酯量测定结果偏高的是________(选填编号)
a.加热时未使用水浴和冷凝管
b.滴定前滴定管内无气泡,滴定后产生气泡
c.滴定管未用硫酸标准溶液润洗
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题四氧化还原反应练习卷(解析版) 题型:填空题
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性,含VO2+、K+、SO42-等。写出该反应的化学方程式_________________________________。
(2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl-。写出并配平该反应的离子方程式,并标出电子转移的数目和方向______________________。
(3)在20.00 mL的0.1 mol·L-1 VO2+溶液中,加入0.195 g 锌粉,恰好完成反应,则还原产物可能是______________________________________________________________。
a.V b.V2+ c.VO2+ d.VO2+
(4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32->Cl->VO2+__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com