
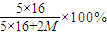 =56.3%,M=31,
=56.3%,M=31,

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
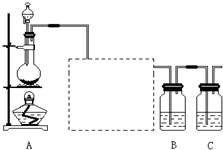 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① |
| |||||
2 | ② | ③ | ④ |
| ⑤ | ⑥ |
|
3 |
| ⑦ | ⑧ |
|
| ⑨ | ⑩ |
(1)表中元素⑩的氢化物的化学式为_________,此氢化物的还原性比元素⑨的氢化物的还原性_________ (填“强”或“弱”)。
(2)某元素的氢化物与其最高价氧化物对应的水化物反应生成盐,则该元素的元素符号是_________,其单质的电子式为__________________。
(3)俗称为“矾”的一类化合物通常含有共同的元素是_________。
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质,写出元素③的氢氧化物与NaOH溶液反应的化学方程式__________________,又如表中与元素⑦的性质相似的不同族元素是_________ (填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① |
| |||||
2 | ② | ③ | ④ |
| ⑤ | ⑥ |
|
3 |
| ⑦ | ⑧ |
|
| ⑨ | ⑩ |
(1)表中元素⑩的氢化物的化学式为____________,此氢化物的还原性比元素⑨的氢化物的还原性____________(填“强”或“弱”)。
(2)某元素的核外K层电子数比L层电子数少3,则该元素的元素符号是____________。
(3)俗称为“矾”的一类化合物通常含有的共同元素是____________。
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式:______________________________,又如与表中元素⑦的性质相似的不同族的元素是____________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ |
| ⑤ | ⑥ |
|
3 |
| ⑦ | ⑧ |
|
| ⑨ | ⑩ |
(1)表中元素⑩的氢化物的化学式为__________,此氢化物的还原性比元素⑨的氢化物的还原性__________ (填强或弱)
(2)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是__________,其单质的电子式为____________________
(3)俗称为“矾”的一类化合物通常含有共同的元素是__________
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式_____________________________又如表中与元素⑦的性质相似的不同族元素是__________ (填元素符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填“强”或“弱”)。
(2)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是 ,其单质的电子式为 。
(3)俗称为“矾”的一类化合物通常含有的共同的元素是 。
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式
,又如表中与元素⑦的性质相似的不同族的元素是 (填元素符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com