
【题目】如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
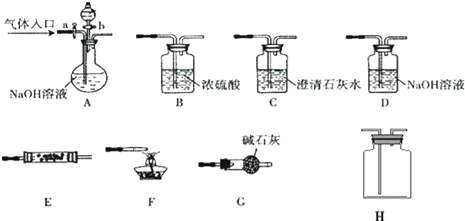
(1)实验前,如何检查A装置的气密:__。
(2)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为__(填代号)。能验证CO氧化产物的现象是__。
(3)若A中气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加NaOH固体,E内放置铂铑合金网,H为空瓶,D中改为石蕊试液,按A→G→E→H→D装置顺序制取干燥的氨气,并验证氨的某些性质。
①实验中先用酒精灯加热催化管,再通入混合气体,可观察到H内有红棕色气体出现,D中石蕊试液变红,则E中发生反应的方程式为__。
②若把酒精灯撤去,继续通入气体,催化剂可继续保持红热状态,反应继续进行.能使催化剂继续保持红热的原因是:__。
③某同学在做上述实验时出现了与其他同学不同的现象,他发现催化剂红热现象明显而正常,但石蕊试液不变红.请分析可能的原因:(答1点即可)__。
【答案】闭活塞a、b,将出气导管口浸没在液面以下,用手掌或热毛巾紧贴烧瓶外壁一小会儿,若出气导管口有气泡冒出,松手或拿走热毛巾后导管内回升一段水柱,证明A装置不漏气 ACBECF AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变浑浊 4NH3+5O2![]() 4NO+6H2O 说明氨的氧化反应是一个放热反应 H、D部分装置的气密性不好;或H瓶不干燥,生成的二氧化氮溶于水
4NO+6H2O 说明氨的氧化反应是一个放热反应 H、D部分装置的气密性不好;或H瓶不干燥,生成的二氧化氮溶于水
【解析】
(1)设法使装置内外形成气压差是气密性检查的常用手段;
(2)用NaOH溶液澄清石灰水除去CO2,用浓硫酸干燥CO,用CuO氧化CO,用澄清石灰水检验CO的氧化产物,燃烧法除去多余的CO;
(3)①氨气催化氧化生成一氧化氮和水;
②放热反应开始后,不需要持续加热;
③催化剂红热现象明显而正常说明生成一氧化氮,石蕊试液不变红,说明H、D部分装置的气密性不好,或者H瓶不干燥,生成的二氧化氮溶于水。
(1)A装置气密性检验方法:关闭活塞a、b,将出气导管口浸没在液面以下,用手掌或热毛巾紧贴烧瓶外壁一小会儿,若出气导管口有气泡冒出,松手或拿走热毛巾后导管内回升一段水柱,证明A装置不漏气;
(2)要获得纯净干燥的CO就必须用A中的NaOH溶液吸收CO2,并通过C中的澄清石灰水不变浑证明CO2已被完全吸收,再通过B浓硫酸干燥CO气体.CO通过E中加热的CuO被氧化成CO2,被C中澄清石灰水吸收变浑浊,证明CO还原性及氧化产物.所选装置的连接顺序为ACBECF,
故答案为:ACBECF;AB之间的C装置中溶液保持澄清,EF之间的C装置中溶液变浑浊;
(3)①氨气催化氧化生成一氧化氮和水,化学方程式:4NH3十5O2![]() 4NO+6H2O;
4NO+6H2O;
②氨的氧化反应是一个放热反应,放热反应开始后,不需要持续加热,催化剂可继续保持红热状态;
③催化剂红热现象明显而正常说明生成一氧化氮,石蕊试液不变红,说明H、D部分装置的气密性不好,或者H瓶不干燥,生成的二氧化氮溶于水。


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:
【题目】现有室温下浓度均为![]() 的几种溶液①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液,回答下列问题:
的几种溶液①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液,回答下列问题:
(1)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③______⑥(填>、=、<),溶液中的离子浓度由大到小的顺序为________________。
(2)将等体积的①、⑤混合,则溶液的pH______7(填>、=、<),用离子方程式说明其原因____________________。
(3)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为_____________,最终产生![]() 总量的关系为__________。
总量的关系为__________。
(4)向相同体积的①、③溶液中分别加入相同浓度、相同体积的![]() 溶液,充分混合后,混合液的pH大小关系为①______③(填>、=、<)。
溶液,充分混合后,混合液的pH大小关系为①______③(填>、=、<)。
(5)若将等体积的⑤、⑥溶液加热至相同温度后,溶液的pH⑤_______⑥(填>、=、<)。
(6)将等体积的②、⑤混合,则溶液中浓度最大的离子是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 水电离的c(H+)=1×10-13mol/L 的溶液中:K+、Na+、SiO32-、SO42-
B. 1.0mol/L的CH3COOH溶液:K+、Fe3+、NO3-、Cl-
C. 在c(OH-):c(H+)=1×1012的溶液: NH4+、Ca2+、Cl-、K+
D. 滴入酚酞试剂不变色的溶液:Na+、CO32-、NO3-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)在化学合成上用作还原剂及催化剂。工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为________(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为_______(填>、<、=)40%。
(2)将111.2g绿矾(FeSO47H2O,式量为278)在高温下加热,充分反应后生成Fe2O3固体和SO2、SO3、水的混合气体,则生成Fe2O3的质量为_______g;SO2为_______mol。实验室可用以下方法制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O,式量为392]。
(3)将4.88g铁屑(含Fe2O3)与25mL 3mol/L H2SO4充分反应后,得到FeSO4和H2SO4的混合溶液,稀释溶液至100mL,测得其pH=1。铁屑中Fe2O3的质量分数是________(保留两位小数)。
(4)向上述100mL溶液中加入与该溶液中FeSO4等物质的量的(NH4)2SO4晶体,待晶体完全溶解后蒸发掉部分水,冷却至t℃,析出摩尔盐晶体12.360g,剩余溶液的质量为82.560g。t℃时,计算(NH4)2SO4·FeSO4·6H2O的溶解度。_______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B代表不同的物质,都是H、N、O、Na中的任意三种元素组成的强电解质, A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。(说明:NH4NO2不稳定,不考虑),请填写下列空白:
(1)写出化学式:A1___________、A2__________、B1___________、B2___________。
(2)已知,Ka(HNO2)=4.60×10-4,则0.01molL-1 HNO2和0.01molL-1 A2等体积混合组成溶液中离子浓度由大到小的顺序为_______________。
(3)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是_________________。
(4)常温下,若B1、B2两种溶液的pH=5,则两溶液中由水电离出的氢离子的物质
的量浓度之比为________。
(5)常温下,0.01molL-1的HCOONa溶液的pH=10,则HCOOH的电离平衡常数Ka=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
己知:Ksp[Fe(OH)3]= 4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为______________________________:
(2)过程I 加入铁屑的主要作用是___________,分离得到固体的主要成分是______,从固体中分离出铜需采用的方法是___________________;
(3)过程II中发生反应的化学方程式为_________________________;
(4)过程II中调节溶液的pH为5,金属离子浓度为__________________。(列式计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各有机物的命名中正确的是( )
A.CH3﹣CH═CH﹣CH3 二丁烯
B.CH3OOCC2H5 乙酸乙酯
C.![]() 2﹣甲基﹣3﹣丁醇
2﹣甲基﹣3﹣丁醇
D.![]() 邻氯甲苯
邻氯甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)某气态有机物相对于氢气的密度为14,则其结构简式为____________。
(2)某有机物的结构简式如图所示,则其一氯代物共有_______种。
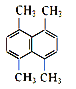
(3)新戊烷用系统命名法命名应为_______。
(4)分别将等物质的量的C3H8、C4H8完全燃烧,消耗氧气质量多的是______(填分子式)。
(5)下列最简式中,只能代表一种有机物的有________(选填对应的序号)。
①CH3 ②CH2 ③CH2O ④CH4O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:①2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
②C3H8(g)+5O2(g)=3CO2(g) +4H2O(g) △H=-2044.0kJ·mol-1
(1)氢气的燃烧热是__________
(2)已知:H2O(l)=H2O(g) △H=+44.0kJ·mol-1,写出丙烷(C3H8)燃烧生成二氧化碳和液态水的热化学方程式:__________
(3)实验测得H2和C3H8的混合气体共3mol,完全燃烧生成液态水时放热2791.6kJ,计算混合气体中H2和C3H8的体积比是_____
(4)恒温恒容条件下,硫可以发生如下反应,其反应过程和能量关系如图所示,已知2SO2(g)+O2(g)=2SO3(g) △H=-196.6kJ·mol-1
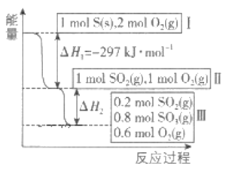
①写出能表示硫的燃烧热的热化学方程式:__________
②△H2=__________kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com