
【题目】2—溴丙酸(CH3CHBrCOOH)是有机合成的重要中间体。实验室制备2—溴丙酸的反应(PCl3易潮解)、装置示意图(加热和夹持装置略去)和有关数据如下:CH3CH2COOH+Br2 → CH3CHBrCOOH+HBr
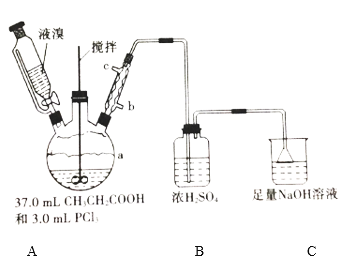
物质 | 相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 |
Br2 | 160 | 3.1 | 58.8 | 微溶于水,易溶于有机 |
CH3CH2COOH | 74 | 0.99 | 141.1 | 易溶于水和有机溶剂 |
CH3CHBrCOOH | 153 | 1.7 | 203(分解) | 能溶于水和有机溶剂 |
请回答:
(1)检验a装置气密性的方法:盖紧滴液漏斗玻璃塞,_____________________,观察到导管口有气泡冒出,撤走热源后,导管中进入一段水柱,则证明气密性良好。
(2)按上图所示添加药品,先水浴加热a,再向a中滴加足量液溴,充分反应后,停止加热。
①a的容积最适合的是__________(填选项字母)
A.50 mL B.100 mL C.250 mL D.500 mL
②冷凝管的出水口为__________(填“b”或“c”)。
③C装置的作用为________________________________________。
(3)冷却至室温后,将a中液体减压蒸馏、纯化,收集得27.0 mL CH3CHBrCOOH。
①采用减压蒸馏的原因为_______________________________________。
②本实验的产率为_________。
(4)欲用上述装置验证a中发生取代反应,需更换B、C中的试剂。则C中应加入的试剂为____________;装置B的作用为____________。
【答案】 将B中长导管末端没入水面下,微热a(或三颈烧瓶) B c 吸收Br2和HBr,防止空气污染 降低CH3CHBrCOOH的沸点,防止CH3CHBrCOOH分解 61% (或60.6%) AgNO3溶液或石蕊溶液 除去HBr中的Br2蒸气
【解析】(1)利用热胀冷缩原理,检验a装置气密性:盖紧滴液漏斗玻璃塞,将B中长导管末端没入水面下,微热a(或三颈烧瓶),观察到导管口有气泡冒出,撤走热源后,导管中进入一段水柱,则证明气密性良好。(2)按上图所示添加药品,先水浴加热a,再向a中滴加足量液溴,充分反应后,停止加热。①a要盛40ml液体加热,容积要大于40ml的2倍,a的容积最适合的是B.100 mL;②冷凝回流液体,b处进水,冷凝管的出水口为c;③C中盛NaOH溶液与溴反应生成NaBr和NaBrO,C装置的作用为吸收Br2和HBr,防止空气污染。(3)冷却至室温后,将a中液体减压蒸馏、纯化,收集得27.0 mL CH3CHBrCOOH。①采用减压蒸馏的原因为降低CH3CHBrCOOH的沸点,防止CH3CHBrCOOH分解。②实际产量:m(CH3CHBrCOOH)=27.0 mL ×1.7g·mL-1=45.9g,理论产量:CH3CH2COOH,37.0 mL ×0.99g·mL-1=36.63g,m(CH3CHBrCOOH)=36.63g/74g·mol-1×153g·mol-1=75.735g,本实验的产率为45.9g/75.735g×100%=61%。(4)欲用上述装置验证a中发生取代反应,需更换B、C中的试剂。则C中应加入的试剂为AgNO3溶液或石蕊溶液;Br2蒸气与水作用生成HBr和HBrO,HBr也能与AgNO3溶液或石蕊溶液,装置B的作用为除去HBr中的Br2蒸气。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列对于“摩尔”的理解正确的是( )
A. 1摩尔H2O质量为18g
B. 摩尔是国际科学界建议采用的一种物理量,简称摩,符号为 mol
C. 22.4LO 2 中所含氧气分子为1 摩尔
D. 1mol 氧含 6.02×10 23 个O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段.如图是硫元素的常见化合价与部分物质类别的对应关系:
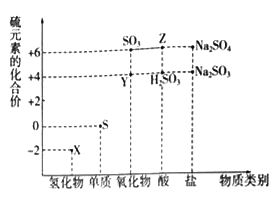
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______(填化学式).
(2)将X与Y混合,可生成淡黄色固体.该反应中氧化剂与还原剂的物质的量之比为_______.
(3)检验物质Y的方法是_______________________________.
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______.
(5)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号).
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)已知Na2SO3能被K2Cr207氧化为Na2SO4则24mL 0.05molL﹣1的Na2SO3溶液与 20mL 0.02molL﹣1的溶液恰好反应时,Cr元素在还原产物中的化合价为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①Cl2+2KBr=2KCl+Br2, ②KClO3+6HCl=3Cl2+KCl +3H2O,
③2KBrO3+Cl2=Br2+ 2KClO3,下列说法正确的是
A. 上述三个反应都有单质生成,所以都是置换反应
B. 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2
C. 反应②中还原剂与氧化剂的物质的量之比为6:1
D. ③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A是合成离分子树脂G和合成酚醛树酯的原料之一。相关的合成路线如下图所示:

已知:Ⅰ. (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
Ⅱ.![]()
请回答下列问题:
(1) 经质谱测定,有机物A的相对分子质量为164,燃烧8.2g有机物A,生成标准状况下11.2LCO2和5.4gH2O。则A的分子式是________,A中所含官能团的名称是________。
(2)B的结构简式________。
(3)C的名称是________,请写出在一定条件下C与足量新制氢氧化铜悬浊液反应的化学方程式________。
(4)D-F的反应类型是________,写出由C和苯酚合成酚醛树脂的化学方程式是___________。
(5)有机物![]() 有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式_________。
有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式_________。
Ⅰ.分子中除苯环外,无其它环状结构;
Ⅱ.核磁共振氯谱显示为5组峰;
Ⅲ.能发生水解反应,不能与Na反应
Ⅳ.能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是
A. 碳酸氢钠溶液直接蒸干得到碳酸氢钠固体
B. 制备Fe(OH)2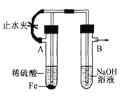
C. 除去CO2中含有的少量HCl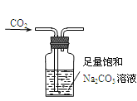
D. 配制100mL 0.1mol/L的稀硫酸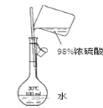
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沙丁胺醇(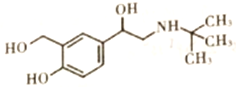 )是一种新型药物,常用于缓解哮喘等肺部疾病,其一种合成路线如下。
)是一种新型药物,常用于缓解哮喘等肺部疾病,其一种合成路线如下。
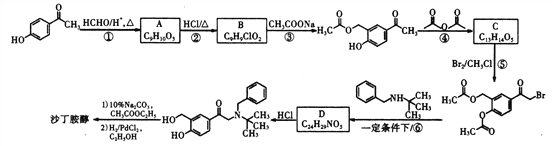
(1)沙丁胺醇的分子式为_____________,C中官能团的名称为_____________。
(2)①的反应类型为____________,⑥的反应类型为____________。
(3)B的结构简式为_____________。
(4)A在酸性条件下发生缩聚反应的化学方程式为__________________________。
(5)符合下列条件的B的同分异构体有________种(不考虑立体异构),其中任意一种的结构简式为_____________。
a.苯环上有两个取代基; b.能与NaHC03反应生成CO2。
(6)写出以苯酚、甲醛和乙酸酐(![]() )为原料制备高分子
)为原料制备高分子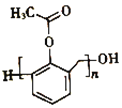 的合成路线:____________________________________________________(无机试剂任选)
的合成路线:____________________________________________________(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰(主要含有SiO2、Fe2O3、Al2O3等)是燃煤发电过程中产生的废渣。粉煤灰的综合利用具有很大的价值。
(1)煤炭在火炉中燃烧很旺时,在往炉膛内的热煤炭上喷洒少量水的瞬间,炉子内火会更旺。如果烧去同量的煤炭,喷洒过水的和没有喷洒过水的煤炭相比较,它们放出的总热量___(填“相同”或“不相同”)。这是因为:________________________。
(2)研究人员通过实验对粉煤灰中铝和铁元素的分离工艺进行了研究。
①以硫酸溶液分解粉煤灰,使其中的铝、铁元素溶出,过滤实现初步分离。向分离所得的滤液中加入还原剂使Fe3+转化为Fe2+,结合下表分析其原因:___________________
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
沉淀区间(pH) | 7.06~895 | 1.94~3.20 | 3.69~4.8 |
②使用碱性较弱的氨水为pH调节剂,进行分离实验。反应终点的pH对铝和铁分离效果的影响如图1。根据实验结果,为达到好的分离效果,反应过程中控制pH的范围是____________。
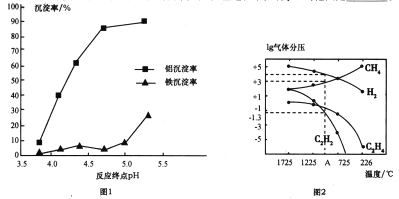
(3)工业上可利用煤的气化产物(水煤气)合成甲烷研究得出,甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图2所示。
①T℃时,向1L恒容密闭容器中充入0.3molCH4只发生反应2CH4(g)![]() C2H4(g)+2H2(g)。达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H___(填“>”或“<”)0,CH4的平衡转化率为________。
C2H4(g)+2H2(g)。达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H___(填“>”或“<”)0,CH4的平衡转化率为________。
②列式计算反应2CH4(g)![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数Kp=________(用平衡分压代替平衡浓度列式计算,不要求写单位,lg0.05=-1.3)。
C2H2(g)+3H2(g)在图中A点温度时的平衡常数Kp=________(用平衡分压代替平衡浓度列式计算,不要求写单位,lg0.05=-1.3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为金属单质,它们之间能发生如下反应(部分产物未标出)
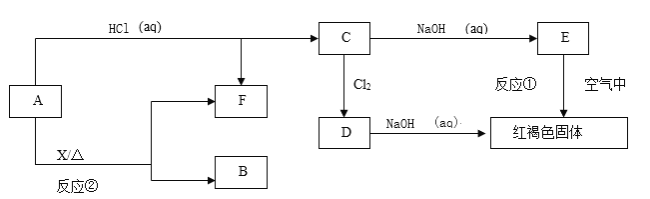
请根据以上信息回答下列问题:
(1)写出物质B、D的化学式:__________________、__________________ 。
(2)写出下列反应的化学方程式:
反应①____________________________________________________________ 。
反应②______________________________________________________________________。
(3)将B溶于盐酸完全反应,试写出反应的离子方程式:___________________________,为证明反应后溶液中浓度较低的金属离子的存在,操作为____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com