
Cyrneine A对治疗神经系统疾病有着很好的疗效。可用香芹酮经过多步反应合成:
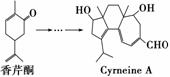
下列说法不正确的是( )
A香芹酮分子式为C9H12O
B.Cyrneine A可以发生加成、消去和氧化反应
C.香芹酮和Cyrneine A均能使酸性KMnO4溶液褪色
D.与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有2种
科目:高中化学 来源: 题型:
下列关于酯类说法正确的是( )
A.乙酸乙酯和甲醛最简式相同
B.酯类都能发生水解反应
C.酯在酸性条件下水解程度比在碱性条件下大
D.只有有机酸和醇才能反应生成酯
查看答案和解析>>
科目:高中化学 来源: 题型:
向30 mL 1 mol·L-1的AlCl3溶液中逐渐加入浓度为4 mol·L-1的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为( )
A.3 mL B.7.5 mL C.15 mL D.17.5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)[2014·江苏,17(4)]
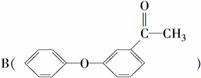 的一种同分异构体满足下列条件:
的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式:___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
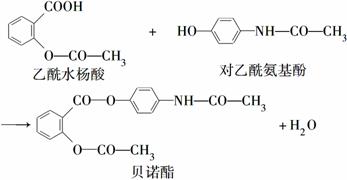
下列有关叙述正确的是( )
A.贝诺酯分子中有三种含氧官能团
B.可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
C.乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D.贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
查看答案和解析>>
科目:高中化学 来源: 题型:
聚氯乙烯是生活中常用的塑料。工业生产聚氯乙烯的一种工艺路线如下:

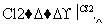 1,2二氯乙烷
1,2二氯乙烷

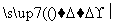 聚氯乙烯
聚氯乙烯
反应①的化学方程式为__________________________________________,
反应类型为__________________,反应②的反应类型为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。合成G的一种路线如下:
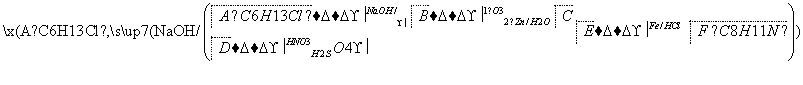

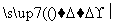

已知以下信息:

②1 mol B经上述反应可生成2 mol C,且C不能发生银镜反应
③D属于单取代芳烃,其相对分子质量为106
④核磁共振氢谱显示F苯环上有两种化学环境的氢
⑤RNH2+O
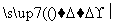
R—N +H2O
+H2O
回答下列问题:
(1)由A生成B的化学方程式为________________________________,反应类型为________________。
(2)D的化学名称是________________,由D生成E的化学方程式为________________________________。
(3)G的结构简式为________________________。
(5)由苯及化合物C经如下步骤可合成N异丙基苯胺:

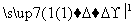

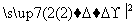

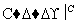
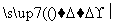

N异丙基苯胺
反应条件1所选用的试剂为________,反应条件2所选用的试剂为________。I的结构简式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对碱性锌锰电池的叙述不正确的是( )
A.Zn是正极,MnO2是负极
B.电解质是KOH溶液
C.Zn发生氧化反应,MnO2发生还原反应
D.它的能量和储存时间比普通锌锰电池高
查看答案和解析>>
科目:高中化学 来源: 题型:
进入2013年以来,我国中东部地区多次遭遇大范围、长时间的雾霾天气。车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。
(1)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
T/℃ n/mol | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.10 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
①结合上表数据,写出NO与活性炭反应的化学方程式 。
②上述反应T1℃时的平衡常数K1= 。
③根据上述信息判断,温度T1和T2的关系是(填序号) 。
a.T1>T2 b.T1<T2 c.无法比较
 (2)车辆排放的氮氧化物和碳氧化物在催化剂作用下可发生反应:
(2)车辆排放的氮氧化物和碳氧化物在催化剂作用下可发生反应:
2CO+2NO N2+2CO2 在一体积为1L的密闭容积中,加入0.40mol的CO和0.40mol的NO ,反应中N2的物质的量浓度的变化情况如图所示,回答下列问题。
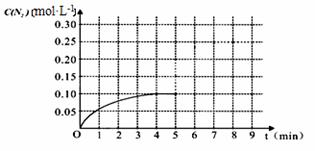
①计算从反应开始到平衡时,平均反应速率v(N2)= 。
②在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时N2的浓度约为0.25 mol·L-1)。请在上图中画出第5分钟末到此平衡时N2浓度的变化曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com