
【题目】甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。
(1)该反应的离子方程式为__________________________。
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:

序号 | A溶液 | B溶液 |
① | 2 mL 0.1 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
② | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
③ | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液和少量MnSO4 |
该实验探究的是______对化学反应速率的影响。在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是____________(用实验序号填空)。
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小。取两支试管各加入2 mL 0.1 mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验目的是研究_________对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是____________。
【答案】2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 浓度和催化剂 ③>②>① 温度 没有加入稀硫酸酸化或高锰酸钾过量导致
【解析】
(1)高锰酸钾具有氧化性,草酸具有还原性,二者会发生氧化还原反应,根据电子守恒、电荷守恒及原子守恒,可得反应的离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)根据表格数据可知①②是探究浓度对化学反应速率的影响;②③是探究催化剂对化学反应速率的影响;在其它条件不变时,增大反应物的浓度,化学反应速率加快;在其它条件不变时,使用催化剂,可以成千上万倍的增大反应速率,速率越快,相同时间产生的气体就越多,所以在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是③>②>①;
(3)将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验目的是研究温度对化学反应速率的影响;草酸和高锰酸钾反应的方程式为:2MnO4-+5H2C2O4+6H+ =2Mn2++ 10CO2↑+ 8H2O,草酸的物质的量为:n(H2C2O4)=0.002L×0.1mol/L=2×10-4mol,高锰酸钾的物质的量为:n(KMnO4)=0.004L×0.1mol/L=4×10-4 mol,由方程式中二者反应的物质的量关系可知,高锰酸钾过量或没有加入稀硫酸酸化,故没看到溶液完全褪色。


科目:高中化学 来源: 题型:
【题目】为了减轻大气污染,可在汽车尾气排放处加装“催化净化器”装置。
(1)通过“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的化学方程式:__。
(2)在一定温度下,向1L密闭恒容容器中充入1molNO、2molCO,发生上述反应,10s时反应达到平衡,此时CO的物质的量为1.2mol。请回答下列问题:
①前10s内平均反应速率v(CO)=___。
②在该温度下反应的平衡常数K=___。
③关于上述反应,下列叙述正确的是___(填字母)。
A.达到平衡时,移走部分CO2,平衡将向右移动,正反应速率加快
B.扩大容器的体积,平衡将向右移动
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度不变,再向容器中充入0.8molCO和0.4molN2,则此时v正>v逆
④已知上述实验中,c(CO)与反应时间t变化曲线Ⅰ如图:

若其他条件不变,将1molNO、2molCO投入2L容器进行反应,请在图中绘出c(CO)与反应时间t1变化曲线Ⅱ___(不要求标出CO的终点坐标)。
(3)测试某汽车冷启动时的尾气催化处理,CO、NO百分含量随时间变化曲线如图:

请回答:
前0~10s阶段,CO、NO百分含量没明显变化的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni﹣Cd)可充电电池在现代生活中有广泛应用。电解质溶液为KOH溶液,电池反应为:Cd+2NiO(OH)+2H2O![]() Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是( )
A.充电过程是化学能转化为电能的过程
B.充电时阳极反应为Cd(OH)2+2e-=Cd+2OH-
C.放电时电池内部OH-向负极移动
D.充电时与直流电源负极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g);△H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol。试回答下列问题:
2SO3(g);△H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol。试回答下列问题:
(1)反应进行到t1时,SO2的体积分数为__;
(2)若在t1时充入一定量的氩气(Ar),SO2的物质的量将__(填“增大”、“减小”或“不变”);
(3)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量_2.1mol(填“<”、“>”或“=”),简单说明原因:__。
(4)若t1达到平衡后,保持容器的体积不再变化。再加入0.2molSO2、0.1molO2和1.8molSO3,此时v逆_v正(填“<”、“>”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】庆祝新中国成立 70 周年阅兵式上,“东风-41 洲际弹道导弹”“歼 20”等护国重器闪耀亮相,它们都采用了大量合金材料。
回答下列问题:
(1)某些导弹的外壳是以碳纤维为增强体,金属钛为基体的复合材料。基态钛原子的外围电子排布式为_____。钛可与 C、N、O 等元素形成二元化合物,C、N、O 元素的电负性由大到小的顺序是_________。
(2)钛比钢轻,比铝硬,钛硬度比铝大的原因是_____。
(3)钛镍合金可用于战斗机的油压系统,该合金溶于热的硫酸生成 Ti(SO4)2、NiSO4,其中阴离子的立体构型为_____,S 的_____杂化轨道与 O 的 2p 轨道形成_____键(填 “π”或“σ”)。
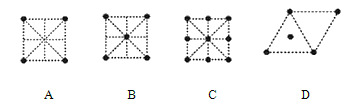
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞的俯视图为_____(填字母序号)。
(5)氮化钛熔点高,硬度大,其晶胞结构如图所示。
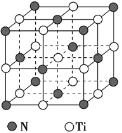
若氮化钛晶体中 Ti 原子的半径为 a pm,N 原子的半径为 b pm,则氮化钛晶体中原子的空间利用率的计算式为_____(用含 a、b 的式子表示)。碳氮化钛化合物在航天航空领域有广泛的应用,其结构是用碳原子代替氮化钛晶胞顶点的氮原子,则这种碳氮化钛化合物的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中成药连花清瘟胶囊在对抗 H1N1病毒中发挥重大作用,其有效成分绿原酸的结构简式如图,下列有关说法错误的是

A. 绿原酸属于芳香族化合物
B. 分子中至少有 7 个碳原子共面
C. 1mol 绿原酸最多可消耗 5mol NaOH
D. 与绿原酸苯环上取代基种类及个数均相同的有机物有5 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家们合成了一种新物质——五星烷,其键线式如图所示。下列有关五星烷的说法正确的是( )

A. 五星烷与乙烷互为同系物 B. 五星烷的化学式为C15H20
C. 五星烷的分子中含有7个五元环 D. 五星烷的一氯代物有3种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com