
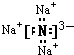 ,
,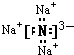 ;离子;
;离子;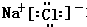 ,氯化铵的电子式为:
,氯化铵的电子式为: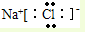 、
、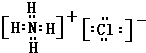 ,
,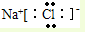 ;
;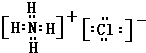 ;
;

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
| A、v(N2)=0.01mol?L-1?s-1 |
| B、v(H2)=0.2mol?L-1?s-1 |
| C、v(H2)=0.6mol?L-1?min-1 |
| D、v(NH3)=1.2mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用反应Zn+2Fe3+═Zn2++2Fe2+设计一个带盐桥的原电池.并在方框内画出实验装置图.并指出正极材料为
利用反应Zn+2Fe3+═Zn2++2Fe2+设计一个带盐桥的原电池.并在方框内画出实验装置图.并指出正极材料为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
- 3 |
2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.5gSiO2晶体中含有的硅氧键数为0.5×6.02×1023 |
| B、84g NaHCO3晶体中含有NA个CO32- |
| C、常温下,将5.6g铁投入足量的稀硫酸中,充分反应,转移电子数为0.3 NA |
| D、常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com