
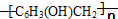 是制作电木的原料.下列围绕此物质的讨论正确的是( )
是制作电木的原料.下列围绕此物质的讨论正确的是( )| A. | 该有机物没有确定的熔点 | B. | 该有机物通过加聚反应得到 | ||
| C. | 该有机物通过苯酚和甲醇反应得到 | D. | 该有机物的单体是-C6H3OHCH2- |
科目:高中化学 来源: 题型:解答题
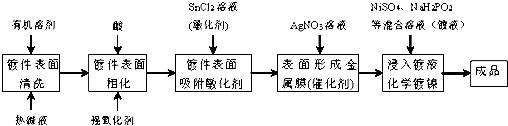
| 反应时间t/s | 1 | 4 | 9 | 16 |
| 镀层厚度y/nm | a | 2a | 3a | 4a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=9.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合溶液中,各种离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 次氯酸钠溶液中通入少量CO2的离子方程式为:2ClO-+CO2+H2O=CO32-+2HClO | |
| C. | 向0.1 mol•L-1CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO-)=5:9,此时溶液的pH=5 | |
| D. | 向浓度均为1.0×10-3 mol•L-1的KCl和K2CrO4混合溶液中滴加1.0×10-3 mol•L-1的AgNO3溶液,CrO42-先形成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将钠粒投入CuSO4溶液中:2Na+Cu2+=Cu+2Na+ | |
| B. | 将NaHSO4溶液滴加到含有酚酞的Ba(OH)2溶液中,溶液由红色变成无色:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 将少量醋酸加入到NaAlO2溶液中:CH3COOH+AlO2-+H2O=CH3COO-+Al(OH)3↓ | |
| D. | 硫化钠溶液中加入少量的氯化铁溶液:S2-+2Fe3+=2Fe2++S↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
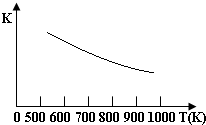 铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)?3FeS(s)+4H2O(g)其温度与平衡常数的关系如图所示.对此反应原理的理解正确的是( )
铁的氧化物可用于脱除煤气中的H2S,有一步反应为:Fe3O4(s)+3H2S(g)+H2(g)?3FeS(s)+4H2O(g)其温度与平衡常数的关系如图所示.对此反应原理的理解正确的是( )| A. | H2S是还原剂 | B. | 脱除H2S的反应是放热反应 | ||
| C. | 温度越高H2S的脱除率越大 | D. | 压强越小H2S的脱除率越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价含氧酸酸性:X<Y | B. | X、Y、Z可形成离子化合物 | ||
| C. | W可形成双原子分子 | D. | M与W形成的化合物含极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
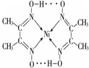 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com