
| A. | ①②③ | B. | ②④⑤ | C. | 仅①③ | D. | ①②③④⑤ |
分析 物质元素组成、同位素、化学键成键方式、同分异构现象、同素异形现象以及物质的状态等许多原因造成物质世界的多样性,据此解答.
解答 解:物质元素组成、同位素、化学键成键方式、同分异构现象、同素异形现象以及物质的状态等许多原因造成物质世界的多样性,
①元素种类多样性,不同的元素可以组成不同的物质,同一元素也可组成不同的物质;
②同位素的存在也是物质世界多样性的原因之一,同种元素可以有不同的核素,例如氢元素存在:11H、21H、31H三种同位素;
③成键方式的多样性也是物质世界多样性的原因之一,例如碳原子之间可以以单键、双键、三键的形式结合;
④同分异形现象的存在也是物质世界多样性的原因之一,相同的分子式,结构不同,可以代表不同的物质,例如C3H6O2,可以表示丙酸、甲酸乙酯、乙酸甲酯等;
⑤同素异形体现象的存在也是物质世界多样性的原因之一,同种元素可以组成不同种单质,例如氧气和臭氧,金刚石和石墨、足球烯;
故选:D.
点评 本题考查了物质世界多样性的原因,题目难度不大,注意从物质的构成、物质的类别和物质的组成元素去分析.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 依据氧化还原反应:
依据氧化还原反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
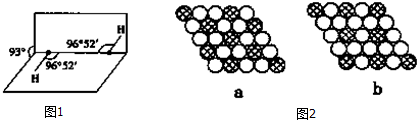
| 熔点/K | 沸点/K | 水中溶解度(标况) | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g苯含有碳碳双键的数目为0.3NA | |
| B. | 标准状况下,足量的Fe与2.24 L Cl2反应转移电子的数目为0.3NA | |
| C. | 1.6 g CH4含有共用电子对的数目为0.5NA | |
| D. | 14.0g由C2H4和C3H6组成的混合气体原子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
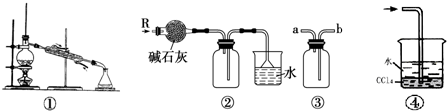
| A. | 装置①可用于由工业酒精制取无水酒精 | |
| B. | 装置②可用于干燥、收集氨气,并吸收多余的氨气 | |
| C. | 装置③可用于排空气法收集NO气体 | |
| D. | 装置④中下层物质若为四氯化碳,则可用于吸收氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,υ正(NH3)=υ逆(H2O) | |
| B. | 达到化学平衡时,4υ (O2)=5υ (NO) | |
| C. | 若单位时间内生成x mol NO的同时,也消耗x mol NH3 | |
| D. | 若单位时间内生成4 mol NO的同时,也生成4 mol NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com