
A.能量守恒原理 B.能量最低原理
C.泡利不相容原理 D.洪特规则
科目:高中化学 来源: 题型:
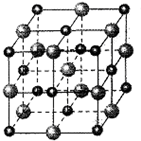 (2010?大连二模)[选修-物质结构与性质]
(2010?大连二模)[选修-物质结构与性质]| 36 |
| da3 |
| 36 |
| da3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
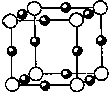 铜是第四周期重要的过渡元素之一,其单质及化合物具有广泛用途.
铜是第四周期重要的过渡元素之一,其单质及化合物具有广泛用途.
查看答案和解析>>
科目:高中化学 来源: 题型:
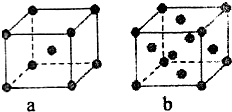 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com