
| A. | C2H6 | B. | C2H4 | C. | C2H2 | D. | C7H8 |
分析 选项中均为烃,完全燃烧时生成CO2与H2O的物质的量之比为2:1,由原子守恒可知,烃中C、H原子个数比为1:1,以此来解答.
解答 解:选项中均为烃,完全燃烧时生成CO2与H2O的物质的量之比为2:1,由原子守恒可知,烃中C、H原子个数比为1:1,
A.C2H6中C、H原子个数比为1:3,故A不选;
B.C2H4中C、H原子个数比为1:2,故B不选;
C.C2H2中C、H原子个数比为1:1,故C选;
D.C7H8中C、H原子个数比为7:8,故D不选;
故选C.
点评 本题考查有机分子式确定的计算,为高频考点,把握原子守恒确定烃中C、H原子个数比为解答的关键,侧重分析与计算能力的考查,注意有机物的燃烧规律,题目难度不大.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
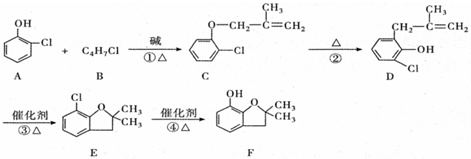
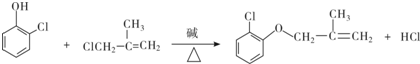 (有机物用结构简式表示,下同).
(有机物用结构简式表示,下同).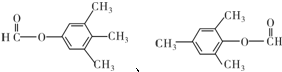
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 36mol | B. | 20mol | C. | 16mol | D. | 20NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4、H2O、O2 |
| ② | Cl2、FeBr2 | FeCl3、Br2 |
| ③ | KMnO4、HCl | Cl2、MnCl2 |
| A. | 第①组反应中,H2O2作还原剂 | |
| B. | 第②组反应中,Cl2与FeBr2的物质的量之比可能为3:2 | |
| C. | 第③组反应中,每生成1mol Cl2转移电子2mol | |
| D. | 从三个反应可以得出:氧化性由强到弱顺序为MnO4->Fe3+>Cl2>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 操作 |
| A | 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
| B | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C | 除去硫酸钡固体中的碳酸钡 | 向盛有足量盐酸的烧杯中加入该固体,用玻璃棒不断搅拌并充分浸泡,静置,过滤,洗涤,烘干 |
| D | 配制100mL1.0mol/LCuSO4溶液 | 将25gCuSO4•5H2O溶于100mL蒸馏水中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com