
【题目】六种短周期元素在元素周期表中的相对位置如图所示,其中R元素的最外层电子数是其次外层电子数的一半。

请回答下列问题:
(1)R的元素名称是_______,中子数为8的X元素的原子是______(用原子组成符号表示)。
(2)上述六种元素,非金属性最强的元素为________________(填元素符号)
(3)Z的最高价氧化物对应水化物的化学式为____________________。
(4)W和Y形成一种二元化合物甲的相对分子质量为184,且Y的质量分数约为30%。则化合物甲的化学式为__________________。化合物甲在摩擦时会发生猛烈爆炸,分解为一种W的单质和一种Y的单质,其中W的单质与Y的单质的相对分子质量之比为64∶7。写出化合物甲爆炸分解的化学方程式:__________________________________。
【答案】 硅 ![]() F H3PO4 N4S4 2 N4S4==4N2↑+S8
F H3PO4 N4S4 2 N4S4==4N2↑+S8
【解析】由短周期元素在周期表中位置,可知X、Y、M处于第二周期,R、Z、W处于第三周期,R元素的最外层电子数是次外层电子数的一半,则最外层电子数为4,故R为Si,可推知X为C、Y为N、Z为P、W为S、M为F。(1)R的元素名称是硅,中子数为8的X元素的原子是; ![]() ;(2)同周期从左到右非金属性逐渐增强,同主族元素从上而下非金属性逐渐减弱,故上述六种元素,非金属性最强的元素为F;(3)Z是磷元素,其最高价氧化物对应水化物的化学式为:H3PO4;(4)S和N形成的一种化合物甲的相对分子质量为184,其中N元素的质量分数约为30%,则分子中N原子数目为
;(2)同周期从左到右非金属性逐渐增强,同主族元素从上而下非金属性逐渐减弱,故上述六种元素,非金属性最强的元素为F;(3)Z是磷元素,其最高价氧化物对应水化物的化学式为:H3PO4;(4)S和N形成的一种化合物甲的相对分子质量为184,其中N元素的质量分数约为30%,则分子中N原子数目为![]() =4,S原子数目为
=4,S原子数目为![]() =4,故化合物甲的化学式为N4S4;化合物N4S4在摩擦时会发生猛烈爆炸,分解为一种S的单质和一种N的单质,其中S的单质与N的单质的相对分子质量之比为64∶7,设单质分别为Sx、Ny,则分子个数比为:
=4,故化合物甲的化学式为N4S4;化合物N4S4在摩擦时会发生猛烈爆炸,分解为一种S的单质和一种N的单质,其中S的单质与N的单质的相对分子质量之比为64∶7,设单质分别为Sx、Ny,则分子个数比为: ![]() =
=![]() ,则x:y=4:1,氮常见的为N2,故硫单质为S8,则化合物N4S4爆炸分解的化学方程式为:2N4S4==4N2↑+S8。
,则x:y=4:1,氮常见的为N2,故硫单质为S8,则化合物N4S4爆炸分解的化学方程式为:2N4S4==4N2↑+S8。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时的反应为Fe+Ni2O3+3H2O ![]() Fe(OH)2+2Ni(OH)2下列推断中不正确的是( ) ①放电时,Fe为正极,Ni2O3为负极
Fe(OH)2+2Ni(OH)2下列推断中不正确的是( ) ①放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是Fe(OH)2+2e﹣═Fe+2OH﹣
③充电时,Ni(OH)2为阳极
④蓄电池的电极必须是浸在某种碱性电解质溶液中.
A.①
B.①②④
C.①③④
D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是( )
选项 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | NO |
C | KOH | HNO3 | CaCO3 | CaO | Mn2O7 |
D | NaOH | HCl | CaF2 | Na2O2 | SO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系如图所示.则甲和X不可能是( )
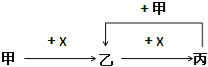
A. 甲为C,X为O2 B. 甲为SO2,X为NaOH溶液
C. 甲为Fe,X为Cl2 D. 甲为AlCl3,X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C,D,E五种元素,其相关信息如表:
元素 | 相关信息 |
A | A原子的1s轨道上只有1个电子 |
B | B是电负性最大的元素 |
C | C基态原子的2p轨道中有3个未成对电子 |
D | D是主族元素且与E同周期,其最外能层 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)写出E元素原子基态时的电子排布式 .
(2)C元素的第一电离能比氧元素的第一电离能(填“大”或“小”).
(3)CA3分子中C原子的杂化类型是 .
(4)A、C、E三种元素可形成[E(CA3)4]2+ , 其中存在的化学键类型有(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl﹣取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为(填序号).
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示.其中D离子的配位数为 , 若该晶体的密度为a gcm﹣3 , 则该晶胞的体积是cm3(写出表达式即可). 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中溴元素以Br形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图所示:
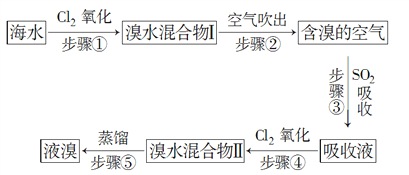
(1)步骤①反应的离子方程式是____________________,步骤③反应的化学方程式是___________________。
(2)从理论上考虑,下列物质也能吸收Br2的是___________(填字母)。
A.NaOH B.FeCl2
C.Na2SO3 D.H2O
(3)步骤③中氧化剂是________,若反应中生成2 mol HBr,则消耗________mol SO2。
(4)根据上述反应判断SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式BaCO3+2H+===CO2↑+H2O+Ba2+中的H+不能代表的物质是( )
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
A. ①③ B. ①④⑤ C. ①⑤ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】质量守恒定律的定量研究对化学科学发展具有重大意义。
(1)下图为某化学反应的微观模拟图,“○”和“![]() ”分别表示两种不同的原子:
”分别表示两种不同的原子:
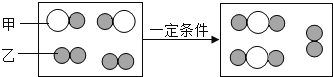
由微粒甲“![]() ”聚集成的物质______(填“可能”或“不可能”)是氧化物,参加反应的甲、乙两种反应物分子的个数比为______,此反应的基本反应类型为______,任举一例符合此反应类型的化学方程式______。
”聚集成的物质______(填“可能”或“不可能”)是氧化物,参加反应的甲、乙两种反应物分子的个数比为______,此反应的基本反应类型为______,任举一例符合此反应类型的化学方程式______。
(2)把m1g镁带放在空气中完全燃烧,通过计算可知,生成氧化镁m2g(只考虑与氧气的反应,下同),则m1______m2(填大于或小于或等于)。小嘉同学在做该实验时,观察到耀眼的白光,冒出大量白烟,称量无误时,发现m1>m2,其原因可能是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com