
| A、c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl) |
| B、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、1.0 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| D、某二元弱酸酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-) |


科目:高中化学 来源: 题型:
| A、③⑤①② | B、③② |
| C、②③④⑤ | D、③④①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.3% |
| B、1.3×10-3% |
| C、0.013% |
| D、1.3×10-3% |
| E、1.3×10-2% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该电池Zn为负极,发生还原反应 |
| B、该电池的正极反应为MnO2+e-+H2O=MnO(OH)+OH- |
| C、放电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn |
| D、电池工作时OH-通过薄层纸片向附着二氧化锰的电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
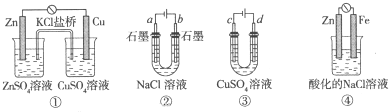
| A、装置①中,盐桥中的K+移向ZnSO4溶液 |
| B、滴有酚酞溶液的装置②在电解过程中,b极先变红 |
| C、可以用装置③在铁上镀铜,d极为铜 |
| D、装置④中发生铁的吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
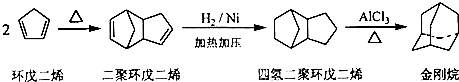

 ,请写出下列反应产物的结构简式:
,请写出下列反应产物的结构简式: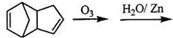
查看答案和解析>>
科目:高中化学 来源: 题型:
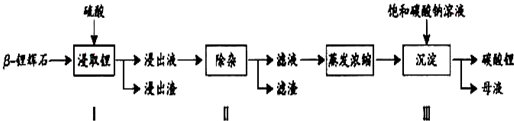
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入Cu粉可以除去FeSO4溶液中的Fe2(SO4)3 |
| B、取少量溶液X,向其中加入适量新制氯水,再加入几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| C、用容量瓶配制1.00mol/L的NaOH溶液,定容时俯视刻度线,会使配出的溶液浓度偏大 |
| D、由于SiO2能与NaOH溶液反应,故NaOH溶液不能用玻璃瓶瓶盛放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com