
| A.AgCl在饱和NaCl溶液中的KSP比在纯水中的KSP小 |
| B.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明KSP(AgCl)<KSP(AgBr) |
| C.将0.001mol?L-1 AgNO3溶液滴入0.001mol?L-1 KCl和0.001mol?L-1 K2CrO4混合溶液中,先产生Ag2CrO4沉淀 |
| D.向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
 Ca2+(aq)+2OH-(aq),Ksp=4.7×10-6 mol3/L3,下列措施可使Ksp增大的是( )
Ca2+(aq)+2OH-(aq),Ksp=4.7×10-6 mol3/L3,下列措施可使Ksp增大的是( )| A.升高温度 | B.降低温度 |
| C.加入适量CaO固体 | D.加入适量Na2CO3固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1.4×10-6 mol/L | B.2.3×10-6 mol/L |
| C.1.4×10-9 mol/L | D.2.3×10-9 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
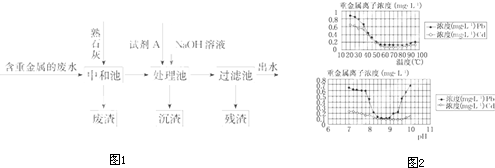
| Cu(OH)2 | CuS | FeS | PbS | HgS | CdS |
| 2.2×10-20 | 8.5×10-45 | 6.3×10-18 | 3.4×10-28 | 4×10-53 | 8×10-29 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.RCl>RI>R2CrO4 | B.RCl>R2CrO4>RI |
| C.R2CrO4>RCl>RI | D.R2CrO4>RI>RCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.25℃时,0.1mol?L-1HF溶液中pH=1 | ||
| B.Ksp(CaF2)随温度和浓度的变化而变化 | ||
C.该体系中Ksp(CaF2)=
| ||
| D.该体系中有CaF2沉淀产生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.x的数值为2×10-5 |
| B.c点时有碳酸钙沉淀生成 |
| C.b点与d点对应的溶度积相等 |
| D.加入蒸馏水可使溶液由d点变到a点 |
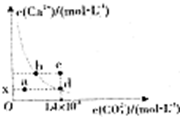
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在放电时,正极发生的反应是Pb(s)+SO42-(aq)-2e-=PbSO4(s) |
| B.在放电时,该电池的负极材料是铅板 |
| C.在充电时,电池中硫酸的浓度不断变小 |
| D.在充电时,阳极发生的反应是PbSO4(s)+2e-=Pb(s)+SO42-(aq) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.黑色沉淀完全转化为白色沉淀 | B.既有氯化银也有硫化银 |
| C.不能由黑色沉淀转化为白色沉淀 | D.只有氯化银白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com