
 �ϳɰ���ҵ����ʡ�����ŵ���Ҫ֧����ҵ֮һ������һ����Ҫ�Ļ���ԭ�ϣ��ڹ�ũҵ�������й㷺��Ӧ�ã�
�ϳɰ���ҵ����ʡ�����ŵ���Ҫ֧����ҵ֮һ������һ����Ҫ�Ļ���ԭ�ϣ��ڹ�ũҵ�������й㷺��Ӧ�ã�| ��ѧ�� | N-H | N��N | Br-Br | H-Br |
| ����/kJ•mol-1 | 391 | 946 | 194 | 366 |
| ʱ��/min | CH4��mol�� | H2O��mol�� | CO ��mol�� | H2 ��mol�� |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | a | 0.80 | c | 0.60 |
| 7 | 0.20 | b | 0.20 | d |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
���� ��1�����淴ӦN2+3H2?2NH3�ﵽ��ѧƽ��״̬ʱ�����淴Ӧ������ȣ��Ҳ�����0�������ʵ�Ũ�Ȳ��ٷ����仯���ɴ�������һЩ�������������仯���÷�Ӧǰ�������壬�����ݻ��̶�����������ܶ�ʼ�ղ��䣬�ݴ˽��н��
��2����Ӧ���ʱ��H=��Ӧ���ܼ���-�������ܼ��ܣ�����Ȼ�ѧ����ʽ��д����д����
��3���ٻ�ѧƽ��״̬ʱ����ֵ�Ũ�Ȳ�����ʱ��ĸı���ı䣬����v=$\frac{��c}{��t}$�����㷴Ӧ�����ʣ�
�������ƽ��ʱ�����ʵ�Ũ�ȣ�Ȼ�����ƽ�ⳣ��K����������Ũ����֮���뷴Ӧ��Ũ����֮���ı������
�۸���Ӱ�컯ѧƽ���ƶ���������������
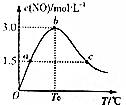
��4����1L�ܱ������г���4molNH3��g����5molO2��g�������������������䣬���c��NO�����¶ȵĹ�ϵ��ͼ��ʾ���¶����ߣ�NOŨ��������С˵������ƽ��������У�����ӦΪ���ȷ�Ӧ����H��0��������м�����ʽ�õ�NH3��ת���ʣ�
��� �⣺��1��A��3v��H2����=2v��NH3��������ѧ��Ӧ����֮���뻯ѧ������֮�Ȳ��ȣ������淴Ӧ���ʲ��ȣ�û�дﵽƽ��״̬����A����
B����λʱ������mmolN2��ͬʱ����3mmolH2��ֻ��˵����Ӧ������У�����˵����Ӧ�ﵽƽ��״̬����B����
C���÷�ӦΪ���������С�ķ�Ӧ����Ӧ��������������ʵ��������仯��������ѹǿҲ�����仯��������ѹǿ������ʱ����仯��˵������ֵ�Ũ�Ȳ��ٱ仯�����淴Ӧ������ȣ��ﵽ��ƽ��״̬����C��ȷ��
D���ܶȦ�=$\frac{m}{��}$���������������䣬����������䣬����������ܶȲ�����ʱ��仯�������ܶȲ�����Ϊ�ж��Ƿ�ﵽ��ѧƽ��״̬�����ݣ���D����ѡC��
�ʴ�Ϊ��C��
��2����������������Ӧ���ɵ������廯�⣬��Ӧ�Ļ�ѧ����ʽΪ��2NH3+3Br2=N2+6HBr��
��Ӧ���ʱ��H=��Ӧ���ܼ���-�������ܼ���=2��3��391KJ/mol+3��194KJ/mol-946KJ/mol-6��366KJ/mol=-214KJ/mol����Ӧ���Ȼ�ѧ����ʽΪ��
2NH3 ��g��+3Br2��g��=N2��g��+6HBr��g����H=-214KJ/mol��
�ʴ�Ϊ��2NH3 ��g��+3Br2��g��=N2��g��+6HBr��g����H=-214KJ/mol��
��3���ٸ���CO��H2�����ʵ����ı仯��������жϣ�5〜7min֮�䷴Ӧ�Ǵ���ƽ��״̬������5minʱ��Ӧ�Ǵ���ƽ��״̬��
ǰ5minƽ����Ӧ����v��CH4��=$\frac{��c}{��t}$=$\frac{\frac{0.4mol-0.2mol}{2L}}{5min}$=0.02mol/L•min-1��
�ʴ�Ϊ���ǣ�0.02mol•min-1��
��CH4��g��+H2O?CO��g��+3H2��g��
��ʼ��mol/L�� 0.20 0.50 0 0
��Ӧ��mol/L�� 0.10 0.10 0.10 0.30
ƽ�⣨mol/L�� 0.10 0.40 0.10 0.30
�÷�Ӧ��ƽ�ⳣ��K=$\frac{0.3{0}^{3}��0.10}{0.10��0.40}$=0.0675��
�ʴ�Ϊ��0.0675��
�۷�Ӧ��7��10min֮�䣬CO�����ʵ������٣�������������ƽ�������ƶ�������һ����̼��Ũ�ȣ�
�ʴ�Ϊ��D��
��4����1L�ܱ������г���4molNH3��g����5molO2��g�������������������䣬���c��NO�����¶ȵĹ�ϵ��ͼ��ʾ���¶����ߣ�NOŨ��������С˵������ƽ��������У�����ӦΪ���ȷ�Ӧ����H��0��������м�����ʽ�õ���T0�¶���NOŨ��Ϊ3mol/L�����ʵ���Ϊ3mol��
4NH3��g��+5O2��g��?4NO��g��+6H2O��g��
��ʼ����mol�� 4 5 0 0
�仯����mol�� 3 3.75 3 4.5
ƽ������mol�� 1 1.25 3 4.5
����ת����=$\frac{3}{4}$��100%=75%��
�ʴ�Ϊ������75%��
���� ������Ҫ�������Ȼ�ѧ����ʽ��д��˹���ɼ��㡢��Ӧ���ʡ�ƽ�ⳣ���ļ��㡢��������Ի�ѧƽ���Ӱ�죬ע�����η��ڼ����е����ã���Ŀ�Ѷ��еȣ�


 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼���� | B�� | ����� | C�� | ��͵� | D�� | �Ⱥ�̼ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
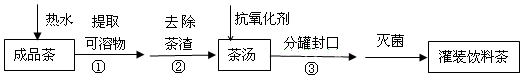
| A�� | ������ȡ | B�� | ���ǹ��� | ||
| C�� | ���Ƿ�Һ | D�� | ά����C������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t/min | 0 | 1 | 3 | 5 |
| N��H2��/mol | 8 | 6 | 5 | 5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
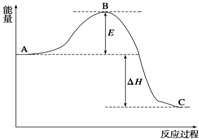 2SO2��g��+O2��g��?2SO3��g������Ӧ���̵������仯��ͼ
2SO2��g��+O2��g��?2SO3��g������Ӧ���̵������仯��ͼ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�VLˮ���е���ԭ�Ӹ���ԼΪV/22.4 NA | |
| B�� | ���³�ѹ�£�1 mol��̼ϩ�� CH2�������ĵ�������Ϊ8NA | |
| C�� | ��״���£���NA���ԭ�ӵ�������ԼΪ22.4L | |
| D�� | 1mol OH-�����⣬�ṩ�ĵ�����ĿΪNA�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
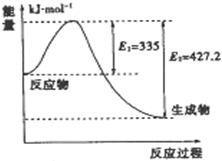 ��ĿǰΪֹ���ɻ�ѧ��ת������ܻ������Ȼ������ʹ�õ�����Ҫ����Դ��
��ĿǰΪֹ���ɻ�ѧ��ת������ܻ������Ȼ������ʹ�õ�����Ҫ����Դ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
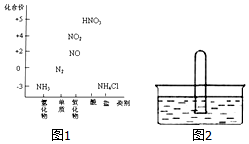 ͼ1Ϊ�����仯���������뻯�ϼ۶�Ӧ�Ĺ�ϵͼ��
ͼ1Ϊ�����仯���������뻯�ϼ۶�Ӧ�Ĺ�ϵͼ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com