
Ca(ClO)2与浓盐酸反应会生成Cl2,该反应的化学方程式为:
Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O
回答下列问题:
(1)浓盐酸在反应中显示出来的性质是________(填字母)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)产生0.3 mol Cl2,则转移的电子的物质的量为____________mol。
(3)此反应的离子方程式为_____________________。
(4)用双线桥法标出该反应的电子转移的方向和数目:_________________________。
(5)配平化学方程式:______KMnO4+_______HC1(浓)=_______KCl+_______MnCl2+_______Cl2↑+______H2O
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2017届江苏省高三上学期期中化学卷(解析版) 题型:填空题
(1)氮和碳的化合物与人类生产、生活密切相关。已知:
N2(g)+O2(g)===2NO(g);ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g);ΔH=-483.6 kJ·mol-1
则反应2H2(g)+2NO(g)===2H2O(g)+N2(g);ΔH= 。
(2)在压强为0.1 MPa条件,将a mol CO和3a mol H2的混合气体在催化剂作用下转化为甲醇的反应为CO(g)+2H2(g) CH3OH(g);ΔH<0。
CH3OH(g);ΔH<0。
①该反应的平衡常数表达式为 。
②若容器容积不变,下列措施可增大甲醇产率的是 (填字母)。
A.升高温度
B.将CH3OH从体系中分离
C.充入He,使体系总压强增大
(3)如图所示的装置能吸收和转化NO2和SO2。
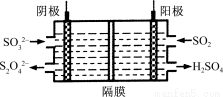
阳极区的电极反应式为 。
②阴极排出的溶液中含S2O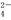 离子,能将NO2气体转化为无污染气体,同时生成的SO
离子,能将NO2气体转化为无污染气体,同时生成的SO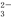 可在阴极区再生。写出该反应的离子方程式: 。
可在阴极区再生。写出该反应的离子方程式: 。
(4)将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如图所示。
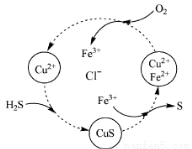
①在图示的转化中,化合价不变的元素是 。
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省娄底市等五校高二上期中化学卷(解析版) 题型:选择题
生产中常要控制化学反应条件增大反应速率。下列措施中不能加快化学反应速率的是
A.尽可能使用稀溶液 B.选择合适的催化剂
C.碾细固体反应物 D.提高反应体系的温度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省哈尔滨市四校高一期中联考化学试卷(解析版) 题型:选择题
下列说法中错误的是 ( )
A.从1L 1 mol·L-1的NaCl溶液中取出10 mL,其浓度仍是1 mol·L-1
B.制成0.5 L 10 mol·L-1的盐酸,需要氯化氢气体112 L(标准状况)
C.0.5 L 2 mol·L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10g 98%硫酸(密度为1.84 g·cm-3)与10mL 18.4 mol·L-1硫酸的浓度是不同的
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省哈尔滨市四校高一期中联考化学试卷(解析版) 题型:选择题
能用H++OH-=H2O来表示的化学反应是( )
A.氢氧化镁和稀盐酸反应
B.Ba(OH)2溶液滴入稀硫酸中
C.二氧化碳通入澄 清石灰水中
清石灰水中
D.澄清石灰水和稀硝酸反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林两省八校高一上学期期中化学试卷(解析版) 题型:选择题
某温度下将Cl。通人KOH溶液里,反应后得到KC1、KC1O、KC1O3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为3:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的质量之比为( )
A.1 : 3 B.4 : 3 C.2 : 1 D.3 : 1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林两省八校高一上学期期中化学试卷(解析版) 题型:选择题
下列有关氧化还原反应的叙述正确的是( )
A.氧化剂被还原,还原剂被氧化
B.有单质参加或生成的反应一定属于氧化还原反应
C.失电子难的物质,获得电子的能力一定强
D.一种元素被氧化,肯定有另一种元素被还原
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林两省八校高二上学期期中化学试卷(解析版) 题型:选择题
在一定条件下,将3 mol A和1 mol B两种气体混合于2L恒容密闭容器中,发生如下反应:3A(g) + B(g)  xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol.L-l。下列判断正确的是( )
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol.L-l。下列判断正确的是( )
A.A的转化率为40%
B.2 min内B的反应速率为0.2 mol.L-l.min-1
C.x=2
D.若混合气体的密度不变,则表明该反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源:2016-2017学年福建省高二上期中化学卷(解析版) 题型:填空题
氨硼烷是一种有效、安全的固体储氢材料,氨硼烷的结构和乙烷相似,如下图。
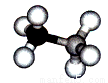
(1)氨硼烷的晶体类型为____________.
(2)氨硼烷分子中氮原子、硼原子的杂化轨道类型分别为 和 .
(3)氨硼烷晶体中存在的作用力有 (填序号)
A离子键 B极性键 C非极性键 D配位键 E金属键 F氢键 G范德华力
(4)硼酸的结构式可表示为 ,请写出硼酸溶于水后溶液显酸性的离子方程式 ________ 。
,请写出硼酸溶于水后溶液显酸性的离子方程式 ________ 。
(5)以NaBH4为硼源、某配合物为氨源可用于制备氨硼烷.为测定该配合物的结构,取2.32g配合物进行如下实验:用重量法分析金属元素,测得镍元素的质量为0.59g;在碱性条件下加热蒸出NH3,用滴定法测出其物质的量为0.06mol;滴加过量硝酸银溶液,有白色沉淀生成,加热,沉淀没有增加;用摩尔法分析含量,测得氯元素质量为0.71g.
①该配合物中镍离子的基态电子排布式为 .
②该配合物的结构简式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com