
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.8 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
| Mn2+ | 7.8 | 9.8 |
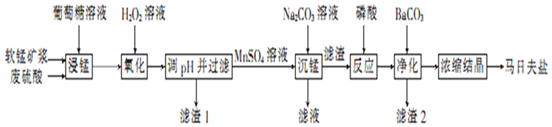
分析 软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO和Al2O3)与废硫酸、葡萄糖混合,得到含有金属阳离子Mn2+、Fe3+、Fe2+、Al3+的溶液,加入过氧化氢溶液氧化Fe2+为Fe3+,调节pH5.0~7.8,沉淀Fe3+、Al3+,滤渣1为Fe(OH)3和Al(OH)3,滤液为MnSO4溶液,加入碳酸钠溶液沉锰,过滤,得到MnCO3沉淀,与磷酸反应:MnCO3+2H3PO4═Mn(H2PO4)2+CO2↑+H2O,加入碳酸钡净化,浓缩结晶得到马日夫盐Mn(H2PO4)2•2H2O,据此分析解答.
解答 解:(1)为增大反应物接触面积,加快反应速率,提高原料利用率,软锰矿要先制成矿浆;葡萄糖(C6H12O6)与MnO2反应时,产物为MnSO4、CO2和H2O,则反应为:12MnO2+C6H12O6+24H2SO4=12MnSO4+6CO2↑+18H2O,二氧化锰为氧化剂,葡萄糖为还原剂,故反应中氧化剂与还原剂的物质的量之比为12:1;
故答案为:增大反应物接触面积,加快反应速率,提高原料利用率;12:1;
(2)过氧化氢溶液氧化Fe2+为Fe3+,反应为:2Fe2++H2O2+2H+═2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(3)调节pH沉淀Fe3+、Al3+,但不能沉淀Mn2+,由表可知,调节pH为5.0~7.8,可以达到目的,故滤渣1为Fe(OH)3和Al(OH)3;
故答案为:5.0~7.8;Fe(OH)3和Al(OH)3;
(4)MnCO3沉淀与磷酸反应为MnCO3+2H3PO4═Mn(H2PO4)2+CO2↑+H2O;
故答案为:MnCO3+2H3PO4═Mn(H2PO4)2+CO2↑+H2O;
(5)软锰矿中MnO2的含量为87%,整个流程中锰元素的损耗率为9%,设得到马日夫盐质量为x,根据锰元素质量守恒,则有$\frac{55}{87}$×1t×87%×91%=$\frac{55}{285}$×x,解得x=2.5935;
故答案为:2.5935.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| A. | 固态硫S8加热变成S2蒸气 | B. | 金刚石在一定条件下转化为石墨 | ||
| C. | 干冰变成CO2气体 | D. | Na2O转化为Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HI、HBr、HCl、HF的沸点依次降低 | B. | O、F、H的原子半径依次减小 | ||
| C. | 干冰、钠、冰的熔点依次降低 | D. | 金属Na、Mg、Al的硬度依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中由水电离出的c(OH-)=10a-14 | |
| B. | 加水稀释,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}$减小 | |
| C. | 该温度下,pH=a的NaOH溶液的物质的量浓度小于0.1mol•L-1 | |
| D. | 加入等浓度、等体积的CH3COOH溶液,所得溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②④⑥ | C. | ①②⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 (1)完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9g,浓碱液增重17.6g.该烃的化学式C4H10,并写出其所有可能的结构简式:CH3CH2CH2CH3、CH3CH(CH3)CH3.
(1)完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9g,浓碱液增重17.6g.该烃的化学式C4H10,并写出其所有可能的结构简式:CH3CH2CH2CH3、CH3CH(CH3)CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它的元素符号为O | |
| B. | 它的核外电子排布式为1s22s22p63s23p4 | |
| C. | 可以与H2化合生成液态化合物 | |
| D. | 其电子排布图为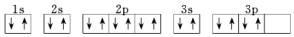 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸氢钙溶液中加入少量烧碱溶液:Ca2++2HCO3-+20H-═CaCO3↓+CO32-+H2O | |
| B. | 碘水中通入足量的 S02:I2+SO2+2H2O═2I-+S042-+4H+ | |
| C. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O═A1O2-+4NH4++2H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(0H)3反应生成Na2FeO4:3ClO+2Fe(OH)3═2FeO32-+3Cl-+H2O+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com