
已知反应:KCl03+6HCl=KCl+3C12↑+3H20,若用K35C103和H37Cl作用,下列说法正确的是( ) A.KCl中只含35C1 B. KCl中只含37Cl
C. KCl中既含35C1又含37Cl D.被氧化和被还原的氯原子个数比为6 ∶ 1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、 B、C、D、E五种短周期元素,元素A最外层电子数与其周期数相等,A与C可形成A2C2和A2C两种化合物,B的最高价氧化物对应的水化物与气体BA3化合生成乙,D+与C2-具有相同的电子数,E元素最高化合价与最低化合价代数和为6。
请回答下列问题:
(1) C在元素周期表中的位置为____________。写出BA3的电子式_______________。
(2)上述元素中,原子半径最大的是____________________(写元素符号)。最高价氧化物对应的水化物中酸性最强的酸是__________________(写化学式)。
(3)化合物乙的水溶液呈酸性,请用离子方程式表示__________________。
(4) A、C、E三种元素按原子个数比1:1:1组成的化合物与BA3反应生成B的单质,写出该反应的化学方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)配平氧化还原反应方程式:
____C2O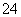 +____MnO
+____MnO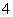 +____H+===____CO2↑+____Mn2++____H2O
+____H+===____CO2↑+____Mn2++____H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液。量取两份此溶液各25.00 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1 NaOH溶液至20.00 mL时,溶液由无色变为浅红色。该溶液被中和的H+的总物质的量为________mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液。
A.KMnO4溶液在滴定过程中作________(填“氧化剂”或“还原剂”),该滴定过程________(填“需要”或“不需要”)另加指示剂。滴至16.00 mL时反应完全,此时溶液颜色由________变为__________。
B.若在接近终点时,用少量蒸馏水将锥形瓶冲洗一下,再继续滴定至终点,则所测结果__________(填“偏大”、“偏小”或“无影响”)。
C.若在达到滴定终点时俯视读数,则所得结果________(填“偏大”、“偏小”或“无影响”)。③原试样中H2C2O4·2H2O的质量分数为________,KHC2O4的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
今有三个氧化还原反应: ①2FeCl3+2KI===2FeCl2+2KCl+I2
②2FeCl2+Cl2===2FeCl3 ③2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中有Fe2+、I-、Cl-共存,要除去I-而不氧化Fe2+和Cl-,则可加入的试剂是( )
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是 ( )
①含氧酸能起氧化作用,无氧酸则不能 ②阳离子只有氧化性,阴离子只有还原性
③失电子难的原子获得电子的能力一定强 ④由X变为X2+的反应是氧化反应
⑤化学反应中,若某元素从化合物中游离出来,则该元素可能被还原,也可能被氧化
⑥发生化学反应时失去电子越多的金属原子,还原能力越强
⑦金属阳离子被还原后,一定得到该元素的单质
A.①②⑦ B.③④⑥ C.④⑤⑦ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
小美在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能
发生反应。你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型和属于氧化还原反应的个数有 ( )。
A.复分解反应、1个 B.分解反应、2个
C.化合反应、3个 D.置换反应、2个
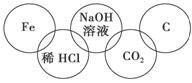
查看答案和解析>>
科目:高中化学 来源: 题型:
与铁相似,金属锡能溶于盐酸生成氯化亚锡,氯化亚锡又能被氯化铁氧化为氯化锡。则下列有关微粒氧化、还原能力的比较中,正确的是( )
A.氧化能力:Sn4+<Sn2+ B.氧化能力:Fe3+<Sn4+
C.还原能力:Fe2+<Sn2+ D.还原能力:Fe<Sn
查看答案和解析>>
科目:高中化学 来源: 题型:
磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O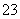 +O2+xOH-===Fe3O4+S4O
+O2+xOH-===Fe3O4+S4O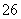 +2H2O。请回答下列问题。
+2H2O。请回答下列问题。
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是_________。(2)反应的化学方程式中x=______。
(3)每生成1 mol Fe3O4,反应转移的电子为________mol,被Fe2+还原的O2的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应mA(g)+nB(s)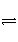
 pC(g)+qD(g),反应过程中,其他条件不变时,产物D的物质的量分数D%与温度T或压强p的关系如下图,下列说法正确的是( )
pC(g)+qD(g),反应过程中,其他条件不变时,产物D的物质的量分数D%与温度T或压强p的关系如下图,下列说法正确的是( )
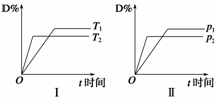
A.降温可使化学平衡向正反应方向移动
B.使用合适的催化剂可使D%有所增加
C.化学方程式中化学计量数:m>p+q
D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com