
氯气在 298 K,100 kPa时,在1 L水中可溶解0.09 mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
298 K,100 kPa时,在1 L水中可溶解0.09 mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为____________________;
(2)估算该反应的平衡常数____________________________(列式计算);
(3)在上述平衡体系中加入少量NaOH固体,平衡将向______________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将________________(填“增大”“减小”或“不变”),平衡将向__________________移动。
科目:高中化学 来源:2016-2017学年安徽省高二上阶段测二化学卷(解析版) 题型:选择题
某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。下列描述正确的是
A.该溶液可能由等物质的量浓度等体积的NaOH溶液和CH3COOH溶液混合而成
B.该溶液可能由PH=3的CH3COOH与pH= 11的NaOH溶液等体积混合而成
C.加入适量NaOH,溶液中离子浓度为 c(CH3COO-) >c(Na+) >c(OH-) >c(H+)
D.加入适量氨水,c(CH3COO-)—定大于c(Na+)、c(NH4+)之和
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省襄阳市四校高一上学期期中化学试卷(解析版) 题型:选择题
下列各组离子一定能大量共存的是( )
A.在无色溶液中:NH4+、Fe2+、SO42-、CO32-
B.在含大量Ba2+溶液中:NH4+、Na+、Cl-、OH-
C.在强碱溶液中:Na+、K+、Cl-、SO32-
D.在强酸性溶液中:K+、Fe2+、Cl-、CH3COO-
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期12月月考化学卷(解析版) 题型:选择题
向盛有Cl2的六个集气瓶甲,乙、丙、丁、戊、己中各注入下列液体中的一种,经过震荡, 现象如下所示,则中、乙、丙、丁、戊、己中注入的液体分别是
①AgNO3溶液②NaOH溶液③水④淀粉-KI溶液⑤FeCl2与KSCN混合液⑥NaBr溶液
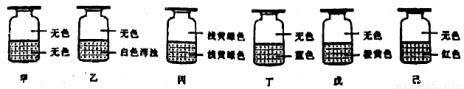
A.②①④⑥⑤③ B.②⑥①③④⑤ C.②⑥③④①⑤ D.②①③④⑥⑤
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期12月月考化学卷(解析版) 题型:选择题
从下列实验事实所列出的相应结论不正确的是
实 验事实 | 结 论 | |
① | SO2使酸性高猛酸钾溶液褪色 | 可证明SO2有漂白性 |
② | 浓盐酸可除去烧瓶内残留的MnO2,稀硝酸可除去试管内壁的银镜,用硫磺粉处理洒落的金属汞 | 都发生了氧化还原反应 |
③ | 取少Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀,再滴加稀盐酸,沉淀不溶解 | 证明Na2SO3己氧化变质 |
④ | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的气体,另取该溶液滴加CaCl2溶液,有白色沉淀生成 | 确定该溶液存在CO32- |
⑤ | 在某溶液中加入适量新制饱和氯水,再加入CCl4震荡,CCl4层呈橙红色 | 该溶液一定有Br-存在 |
A.①③④ B.②③⑤ C.④⑤ D.③④
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上12月考前测试化学卷(解析版) 题型:选择题
①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,不正确的是( )
A.水电离的c(H+):①=②=③=④
B.将②、③溶液混合后,pH=7,消耗溶液的体积:②>③
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.向溶液中加入100 mL水后,溶液的pH:③>④>②>①
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上12月考前测试化学卷(解析版) 题型:选择题
下列我国古代的技术应用中,其工作原理 不涉及化学反应的是( )
不涉及化学反应的是( )
A.火药使用 | B.粮食酿酒 | C.转轮 | D.铁的冶炼 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上段考二化学试卷(解析版) 题型:计算题
将一定质量的镁铝合金投入100mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的氢氧化钠溶液的体积关系如图所示。
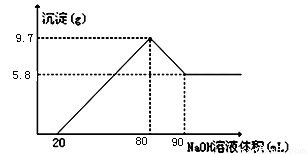
(1)当沉淀达到最大值时,A1(0H)3的物质的量:
(2)原合金中Mg的质量;
(3)盐酸的物质的量浓度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高二上月考二化学试卷(解析版) 题型:填空题
根据水溶液中离子平衡的知识回答下列问题:
I.已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,则
(1)该溶液中c (H+)=________,HA的电离平衡常数Ka=________;
(2)由HA电离出的c(H+)约为水电离出的c (H+)的________倍。
II.常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同,则:B是________,C是________。常温下若B溶液中c(OH-)与C溶液中c(H+)相同,B溶液的pH用pHb表示,C溶液的pH用pHc表示,则pHb+pH c=________(填某个数)。
c=________(填某个数)。
III.将pH=1的稀硫酸慢慢加入一定量的BaCl2溶液中,恰好使Ba2+沉淀完全时溶液的体积为100 mL(混合时溶液体积变化忽略不计),溶液的pH=2,则原BaCl2 溶液中Cl-的浓度为 mol/L。(结果保留两.位.有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com