
(16分)
通过煤的气化和液化,使碳及其化合物得以广泛应用。
I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向1L恒容密闭容器中充人CO和H2O(g),800℃时测得部分数据如下表。
t/min | 0 | 1 | 2 | 3 | 4 |
n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
则该温度下反应的平衡常数K= 。
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1 H2,
此时υ(正) υ(逆) (填“>” “=” 或 “<”)。
II.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283 kJ·mol-1、286 kJ·mol-1、726 kJ·mol-1'。
(3)利用CO、H2合成液态甲醇的热化学方程式为 。
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响 。
III。为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:

一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2—。
(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式 。
(6)已知一个电子的电量是1.602×10—19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH g。
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一。
(7)将CO2转化成有机物可有效地实现碳循环。如:
a.6CO2+6H2O C6H12O6+6O2
C6H12O6+6O2
b.2CO2 + 6H2 C2H5OH +3H2O
C2H5OH +3H2O
c.CO2 + CH4 CH3COOH
CH3COOH
d.2CO2 + 6H2 CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
以上反应中,最节能的是 ,反应c中理论上原子利用率为 。
(16分,每空2分)
(1)1.2(或25/21) (2分) (2)< (2分)
(3)CO(g) + 2H2(g) =CH3OH(l) △H = —129 kJ·mol-1 (2分)
(4)增加压强使反应速率加快,同时平衡右移,CH3OH产率增大。 (2分)
(5)C8H18-50e-+25O2—=8CO2 + 9H2O(或2C8H18-100e-+50O2—=16CO2 + 18H2O)(2分)
(6)80 (2分)
(7)a (2分) 100% (2分)
【解析】
试题分析:(1)该反应的平衡常数K= c(CO2)·c(H2)/ c(CO)·c(H2O),根据表中数据,平衡时,c(CO)=0.15mol/L,c(H2O)=0.35mol/L,则c(CO2)=c(H2)=0.40-0.15=0.25mol/L,所以该温度下的平衡常数为K= c(CO2)·c(H2)/ c(CO)·c(H2O)=25/21;
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1 H2,此时Qc= c(CO2)·c(H2)/ c(CO)·c(H2O)=1×1/0.5×0.5=4>25/21,反应逆向进行,则υ(正)< υ(逆);
(3)CO与氢气反应生成甲醇的化学方程式为CO+2H2=CH3OH,根据所给物质的燃烧热,则该反应的热效应是CO的燃烧热+H2燃烧热的2倍-甲醇燃烧热=283 kJ·mol-1+2×286 kJ·mol-1-726 kJ·mol-1=129kJ/mol,所以CO、H2合成液态甲醇的热化学方程式为CO(g) + 2H2(g) =CH3OH(l) △H = —129 kJ·mol-1;
(4)压强增大,平衡正向移动,甲醇产率增大,同时反应速率加快;
(5)根据电池的装置图,则负极是辛烷发生氧化反应,结合正极产生的O2-,生成二氧化碳和水,所以电极反应式为C8H18-50e-+25O2—=8CO2 + 9H2O;
(6)当电路中通过1.929×105C的电量时,电子的物质的量是1.929×105C/1.602×10—19C/NA=2mol,电解食盐水的化学方程式是2NaCl+2H2O 2NaOH+H2↑+Cl2↑,每转移2mol电子生成2molNaOH,所以生成NaOH的质量是2mol×40g/mol=80g;
2NaOH+H2↑+Cl2↑,每转移2mol电子生成2molNaOH,所以生成NaOH的质量是2mol×40g/mol=80g;
(7)从CO2转化成有机物的反应物与反应条件上判断,a是最节能的,因为反应不需加热和催化剂,且另一种反应物是水,与甲烷、氢气相比,比较廉价,所以a最节能;c中的二氧化碳全部转化为有机物,所以原子利用率是100%。
考点:考查平衡常数的计算、平衡判断,盖斯定律的应用,电化学反应原理的应用,化学方程式的计算


科目:高中化学 来源:2014-2015浙江省高一上学期第三次月考化学试卷(解析版) 题型:选择题
向一定量Fe、FeO、Fe2O3的混合物中,加入50mL 1mol/L硫酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量为
A.11.2g B.5.6g C.2.8g D.无法计算
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第三次月考化学试卷(解析版) 题型:选择题
恒温恒压,反应A+B=C+D,在下列哪种情况下,一定能自发进行
A.△H<0 △S>0 B.△H>0 △S>0
C.△H<0 △S<0 D.△H>0 △S<0
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省乐清市高二上学期10月月考化学试卷(解析版) 题型:选择题
四位同学同时进行反应:A(g)+3B(g)=2C(g)+2D(g) 的速率测定实验,分别测得反应速率如下:①v(A)=0.15mol/(L·s) ②v(B)= 0.6mol/(L·s) ③v(C)= 0.5mol/(L·min) ④v(D)= 0.45mol/(L·s)。其中,反应进行得最快的是
A.① B.② C.③ D.④
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省乐清市高二上学期10月月考化学试卷(解析版) 题型:选择题
下列热化学方程式书写及说法正确的是
A.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= - 890 kJ
B.C(s)+1/2O2(g)=CO(g) ΔH= - 101.5 kJ·mol-1,该方程式的ΔH可表示碳的燃烧热
C.Ba(OH)2(aq)+H2SO4(aq)=BaSO4(s)+2H2O(l) ΔH= - 2a kJ·mol-1,则任何强酸和强碱发生中和反应生成1mol H2O(l)的反应热均为-a kJ·mol-1
D.2mol氢气燃烧得水蒸气放热484 kJ,则H2O(g)=H2(g)+1/2O2(g) ΔH= + 242 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省乐山市高三第一次调查研究考试理综化学试卷(解析版) 题型:选择题
甲、乙、丙、X是中学化学中常见的4种物质,其转化关系符合图。
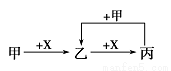
其中甲和X不可能是
A.甲为Fe,X为Cl2
B.甲为SO2,X为NaOH溶液
C.甲为C,X为O2
D.甲为AlCl3溶液,X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市五校高三上学期联合教学质量调研化学试卷(解析版) 题型:填空题
(本题共10分)
化合物A有稳定性好、抗氧化能力强的特点,其结构如

分子中片段X对A的性能起了重要作用,为研究X的结构,将化合物A在一定条件下水解只得到B(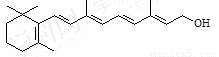 )和C。经测定确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,跟NaHCO3溶液反应有CO2产生。
)和C。经测定确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,跟NaHCO3溶液反应有CO2产生。
完成下列填空:
42.化合物B能发生下列哪种类型的反应_________________
A.取代反应 B.加成反应 C.缩聚反应 D.氧化反应
43.化合物C能经下列反应得到G(分子式为C8H6O2,分子内含五元环)。
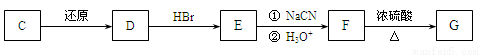
已知:
化合物C的结构简式为____________________________________。
44.反应F→G的化学方程式为___________________________________________________
45.化合物E有多种同分异构体,1H核磁共振谱图表明,其中某些同分异构体含有苯环,且苯环上有两种不同化学环境的氢,写出这些同分异构体中任意三种的结构简式是____________________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市五校高三上学期联合教学质量调研化学试卷(解析版) 题型:选择题
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列)。该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是
A.H2 B.Ag(NH3)2OH溶液 C.HBr D.Br2的CCl4溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省高三上学期12月月考理综化学试卷(A)(解析版) 题型:选择题
硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入5 mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如图所示。则下列叙述中错误的是

A.DE段的方程式为NH4++OH-═NH3?H2O
B.原硝酸溶液中含硝酸的物质的量为0.47mol
C.混合物中铝粉与铁粉的物质的量之比为5:3
D.C点的体积为40mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com