
【题目】下列指定反应的离子方程式正确的是( )
A. 氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B. Na2CO3溶液中CO32-的水解:CO32-+H2O=HCO3-+OH-
C. 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D. NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
科目:高中化学 来源: 题型:
【题目】如图所示是探究发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法不正确的是

A. 两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+
B. 开始时发生的是析氢腐蚀
C. 一段时间后发生的是吸氧腐蚀
D. 析氢反应的总反应式为2Fe+O2+2H2O=2Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节日期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如下图,下列关于该物质的说法正确的是( )
![]()
A. 其分子式为C15H18O4
B. 1 mol该物质完全燃烧,消耗20 mol氧气
C. 既能发生加聚反应,又能发生缩聚反应
D. 既能与FeCl3溶液发生显色反应,又能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入无氧、有氧的浓度均为0.1 mol·L-1的 BaCl2溶液和Ba(NO3)2溶液中,探究体系中微粒间的相互作用,实验记录如下:
实验记录 | |
pH变化 |
|
溶液中是否产生沉淀 | BaCl2溶液(无氧)中无白色沉淀、BaCl2溶液(有氧)中有白色沉淀 Ba(NO3)2溶液(无氧)中有白色沉淀、Ba(NO3)2溶液(有氧)中有白色沉淀 |
下列说法不正确的是
A.曲线a 所示溶液pH降低的原因:SO2 + H2O![]() H2SO3
H2SO3![]() H+ + HSO3-
H+ + HSO3-
B.曲线c 所示溶液中发生反应:2Ba2+ + O2 + 2SO2 + 2H2O =2BaSO4↓+ 4H+
C.与曲线a、b、c对比,可知曲线d所表示的过程中NO3-是氧化SO2的主要微粒
D.依据该实验预测0.2 mol·L-1的KNO3溶液(无氧)也可以氧化SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
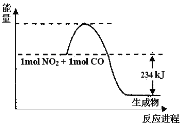
Ⅰ.如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图(图中涉及物质均为气态),请写出NO2和CO反应的热化学方程式:______
Ⅱ.现有①BaCl2②水晶③金属铝④Na2SO4⑤冰⑥碘片六种物质,按下列要求回答(填编号,下同):
(1)熔化时不需要破坏化学键的是_______,熔化时需要破坏共价键的是_______,能导电的是______。
(2)属于离子化合物的是________,只有离子键的物质是________,属于共价化合物的是______。
(3)①的电子式是________;⑤的结构式是________,⑤的空间构型是______,⑤中分子间作用力除了范德华力外,还含有______,因此而引起一些特殊的性质,请举出一种:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(2)酸浸后,钛主要以TOCl42-形式存在,写出相应反应的离子方程式_________________。
(3)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_________________________________________
丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为____________;
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72-还原成Cr3+,反应的离子方程式为___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列4种物质:①NO2②Al(OH)3③FeCl2④SiO2
(1)与水反应产生无色气体的是___(填序号,下同),反应的化学方程式为___。
(2)光导纤维的主要成分是___。
(3)既能与酸反应又能与强碱溶液反应的两性氢氧化物是___,该物质与强碱反应的离子方程式为___。
(4)有人预测①与③的溶液能发生化学反应,可能出现的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为制取乙酸乙酯,在试管a中加入3ml乙醇,然后边振荡试管边慢慢加入2ml浓硫酸和2ml乙酸,按下图所示连接好装置进行实验。请回答:
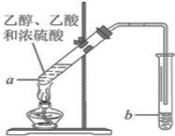
(1)试管b中盛放的溶液是_________________;
(2)实验完成后,试管b的页面上有透明的不溶于水的油状液体产生。若分离该液体混合物需要用到的玻璃仪器是______;
(3)乙醇和乙酸反应生成乙酸乙酯的反应类型是___________;
(4)在制取乙酸乙酯中,有关浓硫酸的作用说法错误的是_______________;
A.催化剂 B.吸水剂 C.脱水剂 D.提高反应速率
(5)试管b中溶液的作用是_______________;
(6)乙酸在酯化反应中断键方式是在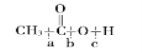 的__________处。
的__________处。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.20 mol/LKMnO4酸性溶液 0.l0L与一定量pH=3.0的草酸(HOOC-COOH)溶液混合,放出VL气体。NA表示阿伏加德罗常数的值,下列说法正确的是
A.9 g HOOC-COOH含共用电子对数目为0.9NA
B.当0.01mol KMnO4 被还原时,强酸提供的H+数目为 0.01NA
C.pH=3.0的草酸溶液含有H+数目为0.001NA
D.该反应释放 CO2分子数目为VNA/22.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com