
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) |
Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A、2CN-+H2O+CO2═2HCN+CO32- |
| B、中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 |
| C、物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)<c(K+)-c(CN-) |
| D、c(NH4+)相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,c(NH4HCO3)>c(NH4CN)>c(HCOONH4) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
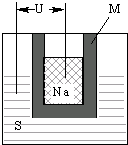 美国福特(Ford)公司于1967年首先发明公布的钠硫电池由于具有高能的诱人特点,受到很多国家极大的重视和发展.图1为钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,该电池的工作温度为320℃左右,电池反应为2Na+xS═Na2Sx,下列叙述正确的是( )
美国福特(Ford)公司于1967年首先发明公布的钠硫电池由于具有高能的诱人特点,受到很多国家极大的重视和发展.图1为钠硫高能电池的结构示意图,M由Na2O和Al2O3制得,该电池的工作温度为320℃左右,电池反应为2Na+xS═Na2Sx,下列叙述正确的是( )| A、M只是用来隔离Na和S |
| B、正极的电极反应式为xS+2e?→Sx2? |
| C、与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的4倍 |
| D、Na+在电池工作过程中朝负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5受到普遍的关注,因为PM2.5在空气中形成了气溶胶,富含大量的有毒、有害物质,对空气质量影响较大(PM2.5是指大气中直径接近于2.5×10-6m的颗粒物) |
| B、李比希燃烧法、钠熔法、铜丝燃烧法、纸层析法、元素分析仪都是元素定性分析法 |
| C、泡沫灭火器是最常见的灭火器之一,其内筒为塑料桶,盛有碳酸氢钠溶液;外筒为铁桶,外筒和内筒之间装有硫酸铝溶液 |
| D、“地沟油”经过加工处理后,可以用来制肥皂和生物柴油,可以实现厨余废物合理利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏水中逐渐加入NaOH(s)的过程中KW不变 |
| B、CaCO3难溶于稀硫酸,更难溶于醋酸 |
| C、在Na2CO3稀溶液中,c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-) |
| D、NaCl溶液和BaCl2溶液中水的KW不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 操作及现象 | 结论 |
| A | 将0.1mol?L-1氨水稀释成0.01mol?L-1,测得pH由11.1变成10.6 | 稀释后NH3?H2O的电离程度减小 |
| B | 常温下,测得饱和Na2CO3溶液的pH大于饱和NaHCO3溶液 | 常温下水解程度:CO32->HCO3- |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 将固体CaSO4加入Na2CO3饱和溶液中,一段时间后,检验固体成分为CaCO3 | 同温下溶解度:CaSO4<CaCO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
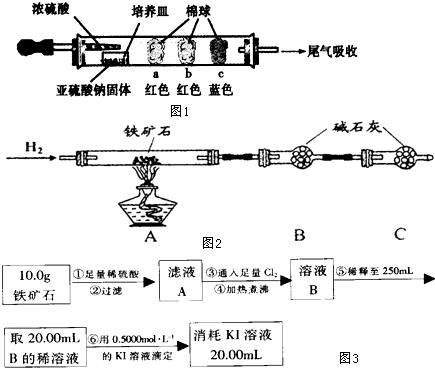
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 棉球变白,微热后又恢复红色 | ||
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | 棉球变为白色 | 该气体具有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 金属离子 | 开始沉淀 | 沉淀完全 |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
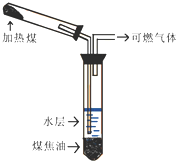 煤的干馏实验如图所示:
煤的干馏实验如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
A、熔融烧碱时,不能使用氧化铝坩埚:Al2O3+2NaOH
| ||||
| B、刻制印刷电路时用FeCl3溶液作为“腐蚀液”:2Fe3++Cu=Cu2++2Fe2+ | ||||
C、打磨后的镁条置于沸水中,滴加酚酞溶液变红色:Mg+2H2O(g)
| ||||
| D、向KI溶液中滴加硫酸酸化的双氧水,溶液呈棕黄色:2I-+H2O2+2H+=I2+O2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com