
 如图是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号.
如图是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号.
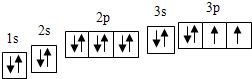 ,
, ;
;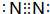 ,HN3溶液与NaOH发生中和反应生成NaX3与水,反应离子方程式为:HN3+OH-═N3-+H2O,
,HN3溶液与NaOH发生中和反应生成NaX3与水,反应离子方程式为:HN3+OH-═N3-+H2O,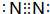 ;HN3+OH-═N3-+H2O;
;HN3+OH-═N3-+H2O; ,
, .
.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
| A、两种气体的压强相等 |
| B、两种气体的氮原子数目不相等 |
| C、两种气体的分子数目相等 |
| D、NO比NO2的质量小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K2CO3和K2O都属于盐 |
| B、H2SO4和HNO3都属于酸 |
| C、KOH和Na2CO3都属于碱 |
| D、Na2O和Na2SiO3都属于氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应物是锌和稀硫酸 |
| B、铜片做阳极 |
| C、电流计显示导线上电子由锌片流向铜片 |
| D、该装置能将化学能转变为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、氮氧化物和可吸入颗粒物是导致雾霾产生的主要原因之一 | ||||
| B、装饰材料中的甲醛、芳香烃及氡等会造成居室污染 | ||||
C、用催化氧化法处理汽车尾气中的CO和NO:CO+NO
| ||||
| D、向污水中投放明矾,利用生成的胶体净水:Al3++3H2O?Al(OH)3(胶体)+3H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com