
��ѧʵ�����г�����Һ���Լ������ữ�������ữ��������ȷ����
A�����Լ���C2H5Cl�е���Ԫ��ʱ����C2H5Cl��NaOH��Һ��ϼ���,��ϡ�����ữ��������������Һ����
B��������Һ��SO42-��CO32-ʱ�����ӵ��Ȼ�����Һ�����������ữ
C��Ϊ��߸��������Һ��������������Ũ���Ὣ���������Һ�ữ
D��ʵ����������Fe2(SO4)3��Һʱ��ͨ���μӼ���ϡ�����ữ
BD
��������
���������A�����Լ���C2H5Cl�е���Ԫ��ʱ����C2H5Cl��NaOH��Һ��ϼ���,Ӧ�ü�ϡ�����ữ��������������Һ���飬����B������������ܺͱ����ӷ�Ӧ���ɲ�����ϡ����İ�ɫ������������Һ���Ƿ���SO42-ʱ�����������ữ�����ų�����������ӵĸ��ţ�������Һ�ټ�BaCl2��Һ��������ְ�ɫ������֤��������������ӣ���֮��û�У���B��ȷ��C��������ؾ���ǿ�����ԣ������Ὣ���������Һ�ữʱ����������ܽ�����������Ϊ��������C����D���Ӽ���ϡ�����ữ�����������������ӵ�ˮ�⣬��D��ȷ����ѡBD��
���㣺���⿼��ʵ���е��ữ����ȷ���ӵ����ʼ����ӵļ����ǽ����Ĺؼ���Cѡ��Ϊѧ������е��״��㣬��Ŀ�ѶȲ���


 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 �������õ��۷��ͷ�������
�������õ��۷��ͷ�������| �� |
| �� |
| 5.85(c1V1-c2V2) |
| m |
| 5.85(c1V1-c2V2) |
| m |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
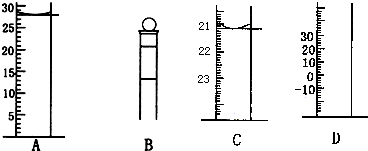
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
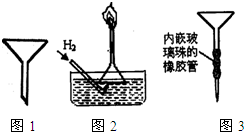 ��1������ʵ��������ʵ����ʵ��������ȷ����
��1������ʵ��������ʵ����ʵ��������ȷ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 1 |
| 2 |
| 1 |
| 2 |
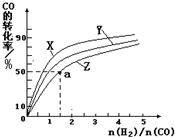
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com