
| A、多电子原子轨道能量高低:4s>3p>3s>2px=2py |
| B、硬度由大到小:金刚石>碳化硅>晶体硅 |
| C、熔点由高到低:NaCl>SiO2>Hg>P4 |
| D、晶格能由大到小:KF>KCl>KB>KI |


科目:高中化学 来源: 题型:
| A、同周期的主族元素中,ⅠA族元素的原子半径最小 |
| B、元素周期表中从ⅢB族到ⅡB族十个纵列的元素都是金属元素 |
| C、ⅥA族元素的原子,其半径越大,气态氢化物越稳定 |
| D、碱金属元素单质与O2反应均可得到多种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、77 | B、114 |
| C、37 | D、268 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯的结构式:CH2CH2 | ||||
B、含78个中子的碘的核素:
| ||||
C、水分子的球棍模型 | ||||
D、氟化氢的电子式:H+[
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在PCl5分子中,磷分子满足最外层8电子结构 |
| B、凡中心原子采取sp3杂化的分子中,其分子几何构型都是四面体 |
| C、在NaCl晶体中,每个Na+的周围有6个Cl- |
| D、sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+:1s22s22p63s23p6 |
| B、F:1s22s22p5 |
| C、S2-:1s22s22p63s23p4 |
| D、Ar:1s22s22p63s23p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:

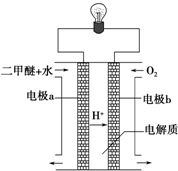


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com