
【题目】无水四氯化锡常用作媒染剂和有机合成中的氯化催化剂。实验室可用熔融的锡(熔点232℃)与Cl2反应制备SnCl4,装置如图。

已知:①SnCl2、SnCl4有关物理性质:

②SnCl4极易水解生成SnO2·xH2O。
回答下列问题:
(1)导管a的作用是_________________________________,装置A中发生反应的离子方程式为____________________。
(2)当观察到装置F液面上方___________时才开始点燃D处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是①_________________________________;②____________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为_________________________________。
(4)Cl2和锡的反应产物有SnCl4和SnCl2,为防止产品中带入过多的SnCl2,可采取的措施是____________________________________________。
(5)滴定分析产品中2价Sn(Ⅱ)的含量:用分析天平称取5.000g产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用0.1000mol·L-1的碘标准溶液滴定至终点时消耗20.00mL,则产品中Sn(Ⅱ)的含量为___________。(已知Sn2++I2=2I-+Sn4+)
【答案】使分液漏斗内液体顺利流下 ![]() 出现黄绿色气体 加快氯气与锡的反应速率 使SnCl4汽化,利于其从混合物中分离出来
出现黄绿色气体 加快氯气与锡的反应速率 使SnCl4汽化,利于其从混合物中分离出来 ![]() 控制Sn与Cl2反应温度在232℃到652℃之间,通入过量的氯气 4.76%
控制Sn与Cl2反应温度在232℃到652℃之间,通入过量的氯气 4.76%
【解析】
A装置中浓盐酸与高锰酸钾反应生成氯气,B中的饱和食盐水除去氯气中的氯化氢;C中的浓硫酸干燥氯气;D是氯气与锡反应的容器;E装置冷凝收集SnCl4;G装置吸收氯气防止污染;SnCl4极易水解生成SnO2·xH2O,F装置中浓硫酸的作用是防止水蒸气进入E。
根据以上分析,(1)导管a连接烧瓶与分液漏斗上口,作用是平衡压强,使分液漏斗内液体顺利流下,装置A中浓盐酸与高锰酸钾反应生成氯气,发生反应的离子方程式为![]() 。
。
(2)为防止锡与氧气反应,要用氯气把空气排出后再加热锡,所以当观察到装置F液面上方出现黄绿色气体时才开始点燃D处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。温度升高反应速率加快,SnCl4的沸点是114℃,加热使SnCl4汽化,利于其从混合物中分离出来,所以继续加热的目的是①加快氯气与锡的反应速率;②使SnCl4汽化,利于其从混合物中分离出来。
(3)若上述装置中缺少装置C,水蒸气进入D中,造成SnCl4水解,则D处发生的主要副反应化学方程式为![]() 。
。
(4)Cl2和锡的反应产物有SnCl4和SnCl2,锡的熔点是232℃,SnCl2的沸点为652℃ ,为防止产品中带入过多的SnCl2,可采取的措施是控制反应温度在232℃到652℃之间,通入过量的氯气。
(5) 设样品中Sn(Ⅱ)的质量为xg,
Sn2+ + I2=2I-+Sn4+
119g 1mol
xg 0.02L×0.1mol·L-1
![]()
x=0.238
产品中Sn(Ⅱ)的含量为![]() 。
。


科目:高中化学 来源: 题型:
【题目】在烃的分子结构中,每减少2个氢原子,则碳碳间便增加一对共用电子。已知分子组成为CnH2n+2 的烃分子中碳碳间的共用电子对数为 n-1,则化学式为CnH2n-2 的烃分子结构中,碳碳间的共用电子对数为 ,Cx 也可视为烃脱氢后的产物,则C60 中碳碳间的共用电子对数为 ;若某碳单质分子中碳碳间的共用电子对数为 140 ,则该单质的分子式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了制取纯净干燥的气体A,可用如图所示装置,生成A的速度可通过滴入液体B的速度控制,已知A是一种无色、无味、不能使酸碱指示剂变色、也不会在空气中燃烧的气体,但能使带火星的木条复燃。

(1)A是________。
(2)若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式是_______________________。
(3)若C是一种黑色粉末,则B物质是________,C物质的作用是__________________。
(4)洗气瓶(广口瓶)中装的试剂D是________,其作用是_______。所制得的气体用________法收集。
查看答案和解析>>
科目:高中化学 来源: 题型:
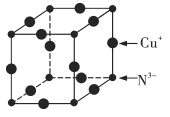
【题目】Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工程等领域中,发挥着广泛的、不可替代的巨大作用。
(1)C、N、O三种元素的第一电离能由大到小的顺序为___________。
(2)与N3-含有相同电子数的三原子分子的空间构型是___________。
(3)Cu+的核外电子排布式为___________,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu。但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2O__________________。
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是___________,乙醇的沸点明显高于乙醛,其主要原因为___________。
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[Cu(H2O)2(Cl)2]具有极性的分子的结构式___________。
(6)Cu3N的晶胞结构如图所示,N3-的配位数为___________,Cu+的半径为apm,N3-的半径为bpm,Cu3N的密度为___________g·cm-3(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是( )
A. 稳定性:HCl>H2SB. 碱性:KOH>NaOH
C. 氧化性:Na+>Al3+D. 沸点:H2O>H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是关于农作物A、B在相同土壤中N、P、K三元素肥效实验的结果记录,“+”表示施肥,“―”表示未施肥)。请据表中的数据,判断正确的结论是( )

A. 对于农作物A来说,其生长发育不需要N元素
B. 对农作物A来说,施肥时最重要的是施加P肥
C. 对农作物B来说,三种元素中K最重要
D. 两种农作物对土壤中N、P、K的需求量基本相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如图实验流程探究海带中碘含量的测定和碘的制取。
实验(一)碘含量的测定

实验(二)碘的制取
另制海带浸取原液,甲、乙两种实验方案如图:

已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
请回答:
(1)实验(一)中的仪器名称:仪器A____,仪器B____。
(2)①分液漏斗使用前须____。
②步骤X中,萃取后分液漏斗内观察到的现象是____。
③实验(二)中操作Z的名称是____。
(3)方案甲中采用蒸馏不合理,理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】作为食品添加剂中的防腐剂G和W,可经下列反应路线得到(部分反应条件略)。
G的制备:


(1)为什么不直接由A→E→G,增加反应A→B和D→E的目的是___________________。
(2)E→G的化学方程式为____________________________________________________。
(3)A是苯酚的同系物,若向苯酚钠溶液中通入少量的CO2气体,会出现__________现象 ,写出该反应的化学方程式_________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com