
����Ŀ������������ԭΪ���ļ��������������Ľ�����ռ��ʮ����Ҫ�ĵ�λ��������¯�з����Ĺؼ���Ӧ���£�
C��s��+O2��g���TCO2��g����H=��393.5kJ/mol
CO2��g��+C��s���T2CO��g����H=+172.46kJ/mol
Fe2O3+CO��Fe+CO2
����֪��2Fe��s��+ ![]() O2��g���TFe2O3��s����H=��824.21kJ/mol
O2��g���TFe2O3��s����H=��824.21kJ/mol
�������������Ȼ�ѧ����ʽ���ش��������⣺
��1��CO��ȼ����Ϊ��д�����Ȼ�ѧ����ʽ ��
��2����¯��Fe2O3��CO��ԭΪFe���Ȼ�ѧ����ʽΪ ��
��3������1t���֣�����96%���������轹̿������������t�����������λ��Ч���֣���ʵ�����������轹̿Զ����������������ԭ���� ��
���𰸡�
��1��282.98KJ/mol��CO��g��+ ![]() O2��g��=CO2��g����H=��282.98KJ/mol
O2��g��=CO2��g����H=��282.98KJ/mol
��2��Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=��24.73kJ?mol��1
��3��0.31����̿û�б��������
���������⣺��1����C��s��+O2��g��=CO2��g����H=��393.5 kJmol��1
��CO2��g��+C��s��=2CO��g����H=172.46 kJmol��1
���ݸ�˹���ɼ���٩��ڵõ���2CO��g��+O2��g��=2CO2��g����H=��565.96KJ/mol��
����ȼ���ȸ����֪��һ����̼ȼ����Ϊ282.98KJ/mol���Ȼ�ѧ����ʽΪ��CO��g��+ ![]() O2��g��=CO2��g����H=��282.98KJ/mol��
O2��g��=CO2��g����H=��282.98KJ/mol��
���Դ��ǣ�282.98KJ/mol��CO��g��+ ![]() O2��g��=CO2��g����H=��282.98KJ/mol����2����C��s��+O2��g���TCO2��g����H=��393.5kJmol��1��CO2��g��+C��s���T2CO��g����H=172.46kJmol��1��2Fe��s��+
O2��g��=CO2��g����H=��282.98KJ/mol����2����C��s��+O2��g���TCO2��g����H=��393.5kJmol��1��CO2��g��+C��s���T2CO��g����H=172.46kJmol��1��2Fe��s��+ ![]() O2��g���TFe2O3��s����H=��824.21kJ/mol
O2��g���TFe2O3��s����H=��824.21kJ/mol
����ݸ�˹���ɢ١� ![]() ���ڡ�
���ڡ� ![]() +�ۣ���Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=��393.5��
+�ۣ���Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=��393.5�� ![]() ��172.46��
��172.46�� ![]() +824.21=��24.73kJmol��1 ��
+824.21=��24.73kJmol��1 ��
���Դ��ǣ�Fe2O3��s��+3CO��g��=2Fe��s��+3CO2��g����H=��24.73kJmol��1����3����CO����Ϊx
Fe2O3 | + | 3CO |
| 2Fe | + | 3CO2 |
84 | 112 | |||||
x | 0.96t |
x=0.72t
��C������Ϊy
2C | + | O2 |
| 2CO |
24 | 56 | |||
y | 0.72t |
y=0.31t
�ֽ�̿û�б�������ã�����ʵ�����������轹̿Զ��������������
���Դ��ǣ�0.31����̿û�б�������ã�
�����㾫����������Ĺؼ���������ȼ���ȵ����֪ʶ��������101kPaʱ1mol H2������ȫȼ�������ȶ���������ʱ���ų����������и����ʵ�ȼ���ȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤��������������������ȷ���ǣ� ��
A.�ڱ�״���£�1L������ȫȼ�պ������ɵ���̬����ķ�����Ϊ ![]() NA
NA
B.1mol̼������CH5+�����ĵ�����Ϊ10NA
C.56g������1mol�����г��ȼ�գ�ʧȥ�ĵ�����Ϊ3NA
D.0.5molC3H8�����к�C��H���ۼ�2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ��������5���Ҽ���һ���м������Ƿֱ��ǣ� ��
A.C��H֮��ֻ��sp2�γɵĦҼ���C��C֮��ֻ��δ�μ��ӻ���2p����γɵĦм�
B.C��C����sp2�γɵĦҼ���C��H֮����δ�μ��ӻ���2p����γɵĦм�
C.sp2�ӻ�����γɦҼ���δ�ӻ���2p����γɦм�
D.sp2�ӻ�����γɦм���δ�ӻ���2p����γɦҼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵĻ�ѧ������ʵ��Ӧ�ö�Ӧ��ϵ��ȷ���ǣ� ��
��ѧ���� | ʵ��Ӧ�� | |
A | NH3����� | ��������� |
B | SO2������������ | ����ֽ��Ư�� |
C | Ư�۾��������� | ����Ư��֯�� |
D | FeCl3�������Һ��Ӧ | ����ʴ��ͭ����·�� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӻ�������ȡ�⣬�мס�������ʵ�鷽����ͼ1����֪��3I2+6NaOH=5NaI+NaIO3+3H2O����ش�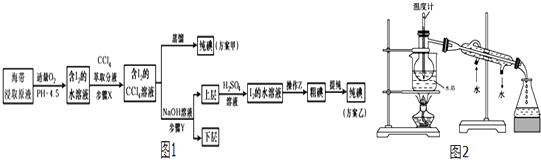
��1������Xʹ�÷�Һ©��ǰ���©����©����Ϊ ��
��2����ͼ��ʾװ�ý�������ָ����ͼ��ʾʵ��װ�� �е������������� ��
��3��������������ʱ��ʹ��ˮԡ���ȸ��õ�ԭ���������⾧������ۼ���
��4�������йز���Y��˵������ȷ���� ��
A.Ӧ���� NaOH ��Һ��Ũ�Ⱥ����
B.����ת�������ӽ���ˮ��
C.��Ҫ�dz�ȥ������ȡԭҺ�е��л�����
D.NaOH ��Һ�������Ҵ�����
��5�����������ϲ���Һ�м���H2SO4��Һ�õ�I2��ˮ��Һ�����ķ�Ӧ����ʽ�ǣ���
��6������Z�������� ��
��7����ҵ�в��÷����ҴӺ�������ȡ�⣬�������в����������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10L�����У�����2mol��SO2��g����2mol��NO2��g���������¶Ⱥ㶨��������Ӧ��SO2��g��+NO2��g��SO3��g��+NO��g�������ﵽƽ��״̬ʱ�����������SO2��g����ת����Ϊ50%��
�����¶��¡��������У��ټ�������1mol��SO2��g������
��1����ѧƽ�⽫�������ƶ���NO2��ת���ʽ�������������䡱��С������
��2�������㣬���ﵽ�µ�ƽ��״̬ʱ��������SO2��g����Ũ����mol/L��
��3�����������У�SO2��ת������50%��Ϊ%��NO2��ת������%��Ϊ%��
��4�������������ǵ���ʾ�ǣ�����һ�ַ�Ӧ�������������ת���ʽ�������������䡱��С������һ��Ӧ���ת���ʽ�������������䡱��С��������ʵ�����е������ǣ�����ͨ������������������߳ɱ��ߵķ�Ӧ��������ʣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʷ������ȷ�����
��� ��� | ���������� | ���������� | �� | �� | �� |
A | CO2 | A12O3 | H2SO4 | KOH | NaHCO3 |
B | CO | Na2O | HC1 | NaOH | NaCl |
C | SO2 | Na2O2 | CH3COOH | Na2CO3 | CaF2 |
D | SO3 | CaO | HNO3 | Ca(OH)2 | CaCO3 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A. 32gO2ռ�е����ԼΪ22.4L
B. 22.4 LN2���а����ӵ�������������
C. �ڱ�״����,22.4Lˮ������ԼΪ18 g
D. 22 g������̼���״����11.2 LHCl������ͬ�ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������AlN����һ���������ǽ������ϣ�����ȡԭ��Ϊ��Al2O3+3C+N2 ![]() 2AlN+3CO������ȡ������ʱ���ڷ�Ӧ����ȫ����Ʒ������������̼��Ϊ�˷���ijAlN��Ʒ����ɣ�ijʵ��С�����������̽����
2AlN+3CO������ȡ������ʱ���ڷ�Ӧ����ȫ����Ʒ������������̼��Ϊ�˷���ijAlN��Ʒ����ɣ�ijʵ��С�����������̽����
��1����ʵ��1���ⶨ��Ʒ�е�Ԫ�ص�����������
ȡһ��������Ʒ��������װ�òⶨ��Ʒ��AlN�Ĵ��ȣ��г�װ������ȥ����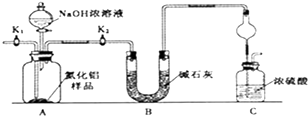
��֪��AlN+NaOH+H2O�TNaAlO2+NH3��
��i����ͼCװ�������θ���ܵ������� ��
��ii���������ʵ�鲽�裺��װ��ʵ��װ�ã����� �� �ټ���ʵ��ҩƷ��Ȼ�� ��
��Һ©������������NaOHŨ��Һ�������ٲ������壮��K1 �� ����ͨ�뵪��һ��ʱ�䣬�ⶨCװ�÷�Ӧǰ��������仯��ͨ�뵪����Ŀ���� ��
��iii����ȥ��װ��B�����²ⶨ���ƫ��
���ƫ�ߡ�����ƫ�͡�����Ӱ�족������������װ�û�����ȱ�ݣ����²ⶨ���ƫ�ߣ�������Ľ���� ��
��2����ʵ��2�������²���ⶨ��Ʒ����Ԫ�ص����������� 
��i����������ɳ��������ӷ���ʽΪ ��
��ii����������Ҫ�IJ��������� ��
��iii�����ˡ�ϴ��
��iv��AlԪ�ص���������Ϊ����m1��m2��ʾ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com