
【题目】按要求回答问题。
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。反应时释放大量热并快速产生大量气体。已知在101kPa,298K时,1mol液态N2H4在氧气中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是____________ 。
又知:H2O(g )=H2O (l) △H=-44 kJ·mol-1,若1mol液态N2H4在氧气中完全燃烧生成N2和液态水,则放出热量为__________kJ。
(2)已知拆开1molH-H键、1molN-H键、1molN≡N键分别需要能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式是___________________________。
(3)写出分子式为C8H10含苯环的所有同分异构体_________________________________。
【答案】N2H4(l)+ O2(g)= N2(g)+ 2H2O(g) ΔH=-624KJ/mol712N2(g)+3 H2 (g) ![]() 2NH3(g) ΔH=-92KJ/mol略
2NH3(g) ΔH=-92KJ/mol略
【解析】
(1)在101kPa(25℃时)时,已知1mol液态肼与足量氧气反应,生成氮气和水蒸气,放出624KJ的热量,则该反应的热化学方程式为:N2H4(1)+O2(g)=N2(g)+2H2O(g)△H=-624kJ/mol;如果生成液态水,1mol肼完全反应放出的热量为:624kJ+44×2kJ=712kJ,故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-624KJ/mol;712;
(2)因反应的焓变等于反应物的键能之和减去生成物的键能之和,则生成氨反应的焓变△H=946+3×436-6×391=-92(92KJ/mol),故答案为:N2(g)+3 H2 (g) ![]() 2NH3(g) ΔH=-92KJ/mol;
2NH3(g) ΔH=-92KJ/mol;
(3)分子式为C8H10含苯环的所有同分异构体有: ,故答案为:
,故答案为: 。
。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,11.2LO3所含的原子数为1.5NA
B. 常温常压下,18gH2O所含的分子数为NA
C. 标准状况下,16gO2所含的原子数为6NA
D. 标准状况下,11.2L氢气和氦气的混合气体所含的原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(CH3NH2)是一种应用广泛的一元弱碱。常温下,向200mL0.10mol/L的甲胺溶液中滴加V mL.0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是
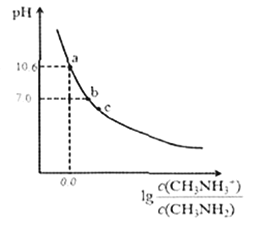
A. b点对应加入盐酸的体积V< 20.00mL
B. 甲胺在水中的电离方程式为:CH3NH2+H2O![]() CH3NH3++OH-
CH3NH3++OH-
C. 常温下,甲胺的电离常数为Kb,则pKb=-1gKb=4.3
D. c点可能存在关系: 2c(H+)+ c(CH3NH3+)=c(CH3NH2) +2c(OH- )+ c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是 ( )
① pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
② 1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液含NH4+ 物质的量完全相等
③ pH相等的四种溶液:a.CH3COONa b.NaClO c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
④ pH=8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3)
⑤ pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-) ≤ c(H+)
⑥ pH=4浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
A. ③⑤⑥ B. ①③⑤ C. ①②④ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. MgCO3![]() MgCl2(aq)
MgCl2(aq)![]() Mg
Mg
B. NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
C. Cu2(OH)2CO3![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2
D. SO2![]() NH4HSO3
NH4HSO3![]() (NH4)2SO4
(NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.5 g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶于水,制成稀溶液,然后向该溶液中逐滴加入1 mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:(提示:碳酸钠与少量盐酸反应生成碳酸氢钠和氯化钠。)
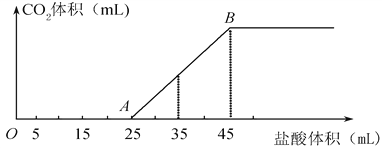
(1)写出OA段所发生反应的化学方程式___________________________。
(2)当加入35 mL盐酸时,产生CO2的体积为________mL(标准状况)。
(3)原混合物中NaOH的质量为________g,碳酸钠的质量分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com