镁、铝合金3g与100mL稀H2SO4恰好完全反应,将反应后所得溶液蒸干,得无水硫酸盐17.4g,则原硫酸溶液的物质的量浓度为( )
A.1.5mol/L
B.1mol/L
C.2.5mol/L
D.2mol/L
【答案】
分析:镁、铝合金3g与100mL稀H
2SO
4恰好完全反应,将反应后所得溶液蒸干,得无水硫酸盐17.4g为硫酸镁和硫酸铝的质量,根据镁、铝质量守恒计算硫酸根的质量,再计算出硫酸根的物质的量,利用硫酸根守恒计算溶质硫酸的物质的量,据此解答硫酸的物质的量浓度.
解答:解:17.4g为硫酸镁和硫酸铝的质量,
由于镁、铝合金3g,所以17.4g中硫酸根的质量为17.4g-3g=14.4g,
所以硫酸根的物质的量为
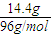
=0.15mol,
所以100mL稀H
2SO
4含有溶质硫酸的物质的量为0.15mol,
所以该稀硫酸的浓度为
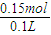
=1.5mol/L,
故选A.
点评:本题考查根据方程式进行物质的量浓度的计算,难度中等,本解法采取守恒法计算硫酸根的质量及硫酸的物质的量,简化计算.

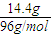 =0.15mol,
=0.15mol,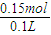 =1.5mol/L,
=1.5mol/L,
