
| A.Fe3+和Cu2+ | B.Fe2+和Cu2+ | C.Fe2+ | D.Fe2+和Fe3+ |
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源:不详 题型:填空题
 2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。
2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 预期现象与结论 |
| 步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加1~2滴氯水。 | ; |
| 步骤2:____________________________________ ____________________________________。 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.因为NH3·H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3 |
| B.向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色 |
| C.向一定体积的热浓硫酸中加入过量的铁粉,生成的气体能被烧碱溶液完全吸收 |
D.将SO2气体通入溴水,欲检验溶液中是否有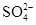 生成,可向溶液中滴加Ba(NO3)2溶液 生成,可向溶液中滴加Ba(NO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
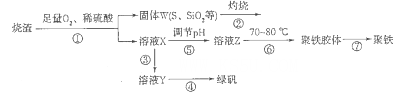
 xH2O)。有如下操作:
xH2O)。有如下操作:
 xH2O)中的x值,某学生设计了两种实验方案:
xH2O)中的x值,某学生设计了两种实验方案:查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 样品含有少量
样品含有少量 杂质。现要测定其中
杂质。现要测定其中 的质量分数,实验按以下步骤进行:
的质量分数,实验按以下步骤进行:

 溶液18.00mL。该样品中
溶液18.00mL。该样品中 (式量为270.5)的质量分数为_____________。
(式量为270.5)的质量分数为_____________。 杂质除去,可用的试剂是________(选填编号)。
杂质除去,可用的试剂是________(选填编号)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com