
| A. | X的主要化合价是-2、+4、+6 | |
| B. | 可以形成稳定的气态氢化物 | |
| C. | X的最高价氧化物对应水化物的酸性比HBrO4的酸性强 | |
| D. | X原子的还原性比碘原子强 |
分析 元素X的原子序数为52,则核外各层电子数分别为2、8、18、18、6,为第五周期ⅥA族元素Te,结合同主族元素的性质的相似性和递变性解答该题.
解答 解:元素X的原子序数为52,则核外各层电子数分别为2、8、18、18、6,为第五周期ⅥA族元素Te,
A.X为Te元素,位于ⅥA族,性质与S相似,则主要化合价是-2、+4、+6,故A正确;
B.非金属性比S弱,则气态氢化物不稳定,故B错误;
C.非金属性比Br弱,则最高价氧化物对应水化物的酸性比HBrO4的酸性弱,故C错误;
D.非金属性比碘弱,金属性比碘强,还原性较强,单质的氧化性比碘弱,故D错误.
故选A.
点评 本题考查元素周期表的结构及应用,为高频考点,把握周期表中原子序数及元素的位置、元素周期律的应用为解答的关键,侧重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在上述条件下,SO2可能100%的转化为SO3 | |
| B. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| C. | 达到平衡时,SO2与SO3的浓度保持不变 | |
| D. | 为了提高SO2的转化率,可以适当提高O2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
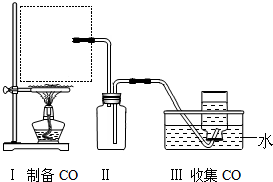
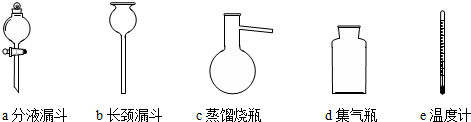

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
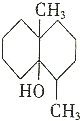 当天空降雨时,雨水会刺激土壤释放出一种称为土臭素的化学物质,其结构简式如图所示.下列试剂(可加热)不与土臭素反应的是( )
当天空降雨时,雨水会刺激土壤释放出一种称为土臭素的化学物质,其结构简式如图所示.下列试剂(可加热)不与土臭素反应的是( )| A. | 金属钠 | B. | 醋酸和浓硫酸的混合溶液 | ||
| C. | 酸性高锰酸钾溶液 | D. | 碳酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
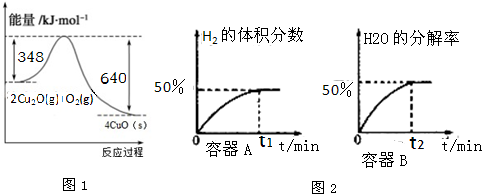
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com