
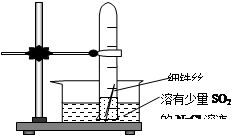


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:不详 题型:实验题

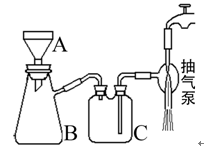
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
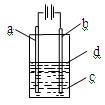
| A.纯水 | B.AgNO3溶液 | C.NaOH溶液 | D.CuCl2溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
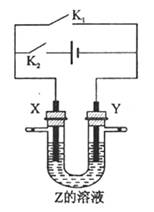
| A.若关闭K2,打开K1,X、Y均为石墨,Z是NaCl,则X附近能得到氢氧化钠 |
| B.若关闭K2,打开K1,X是纯铜,Y是粗铜,Z是CuSO4,该装置可用于铜的楮炼 |
C.若关闭K1,打开K2,X是Cu铜,Y是是H2SO4,则溶液中的 移向Y极 移向Y极 |
| D.若关闭K1,打开K2,X是Cu铜,Y是Fe,Z是含有空气的海水,该装置可用于保护Fe |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
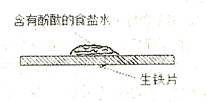
| A.食盐水中有气泡逸出 |
B.铁表面的反应为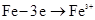 |
| C.红色首先在食盐水滴的中心出现 |
| D.该实验研究的是金属的吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
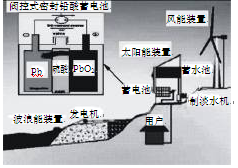
| A.图中涉及的能量转化方式只有3种 |
| B.该发电工艺可实现零排放 |
| C.蓄电池供电时,负极的电极反应为:Pb-2e-=Pb2+ |
| D.储能时若充电时间过长,阳极流向阴极的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 被腐蚀
被腐蚀 ______ _,负极:__________________________________________________________。
______ _,负极:__________________________________________________________。| A.采用纯铁制造潜艇外壳 | B.采用耐腐蚀的合金制造潜艇外壳 |
| C.在潜艇上涂一层油 | D.在潜艇外壳上装一定数量的锌块 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com