
| 操作 | 现象 | 结论 | |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+无K+ |
| C | 滴加氯水和CC14,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.白色沉淀可能为AgCl或硫酸钡;
B.观察K的焰色反应透过蓝色的钴玻璃;
C.下层溶液显紫色,可知氯气氧化碘离子生成碘单质;
D.滴加几滴稀NaOH溶液,可能生成一水合氨.
解答 解:A.白色沉淀可能为AgCl或硫酸钡,则原溶液中可能含硫酸根离子或银离子,但二者不能同时存在,故A错误;
B.观察K的焰色反应透过蓝色的钴玻璃,则由现象可知原溶液中有Na+,不能确定是否含K+,故B错误;
C.下层溶液显紫色,可知氯气氧化碘离子生成碘单质,则原溶液中有I-,故C正确;
D.滴加几滴稀NaOH溶液,可能生成一水合氨,则原溶液中可能含NH4+,故D错误;
故选C.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、现象、结论为解答的关键,侧重分析与实验能力的考查,注意排除干扰离子的影响,题目难度不大.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:多选题
| A. | 用溴水除去NaCl溶液中的NaI | |
| B. | 用NaOH溶液与HCl溶液制备NaCl | |
| C. | 用NaOH溶液除去乙酸乙酯中的溴 | |
| D. | 用冷却饱和溶液法提纯含少量NaCl杂质的KNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用水银温度计测量烧杯中的水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中 | |
| B. | 用试管夹从试管底部往上夹住距试管口约$\frac{1}{3}$处,手持试管夹长柄末端,进行加热 | |
| C. | 使用滴管取液时,先将滴管伸入试剂瓶中,然后用手指捏紧橡胶乳头,赶出滴管中的空气,放开手指,试剂即被吸入 | |
| D. | 把玻璃导管插入橡胶塞孔时,用厚布护手,紧握用水湿润的插入端,缓慢旋进塞孔中 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
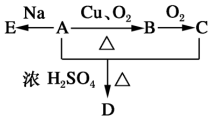 化合物A(C4H10O)是一种有机溶剂,A可以发生如图变化:
化合物A(C4H10O)是一种有机溶剂,A可以发生如图变化:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2既是氧化剂又是还原剂 | |
| B. | Fe2O3在反应中显氧化性 | |
| C. | 1molNa2O2发生反应,有4mol电子转移 | |
| D. | 在Na2FeO4能消毒杀毒是因其具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H++2e-=H2↑ | B. | Fe-3e-=Fe3+ | ||
| C. | Fe-2e-=Fe2+ | D. | O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为 283 kJ | |
| B. | 反应①正反应活化能与逆反应活化能之差为+566 kJ/mol | |
| C. | 反应 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO(g)与 Na2O2(s)反应放出 509 kJ 热量时,电子转移数为 6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com