
分析 易水解的盐,若水解生成强碱或难挥发性强酸,则蒸干其溶液得到原物质,若水解生成易挥发性的酸,则蒸干其溶液得到氢氧化物;碳酸氢盐受热易分解,蒸干得到碳酸盐,Mg(HCO3)2在溶液中水解生成氢氧化镁,据此分析.
解答 解:(1)Na2CO3在溶液中水解生成碳酸氢钠和氢氧化钠,水解方程式为:Na2CO3+H2O?NaOH+NaHCO3,由于生成的NaOH不挥发,氢氧化钠能够与碳酸氢钠发生中和反应生成碳酸钠和水,所以将Na2CO3溶液加热蒸发后最终得到的固体仍然为Na2CO3,故答案为:Na2CO3;
(2))(NH4)2SO4在溶液中水解生成难挥发性强酸硫酸和NH4HSO4,浓度增大时二者又重新生成(NH4)2SO4,则蒸干得到的固体物质是(NH4)2SO4;
故答案为:(NH4)2SO4;
(3)Ba(HCO3)2受热易分解,溶液蒸干得到的碳酸盐BaCO3,故答案为:BaCO3;
(4)Na2SO3有很强的还原性,所以溶液蒸干时被空气中的氧气氧化,得到的固体物质是Na2SO4;故答案为:Na2SO4;
(5)Mg(HCO3)2在溶液中水解生成氢氧化镁,所以Mg(HCO3)2溶液蒸干得到的固体物质是Mg(OH)2,故答案为:Mg(OH)2;
(6)Fe2(SO4)3在溶液中水解生成硫酸和Fe(OH)3,但由于硫酸不挥发,故水解不能被促进,硫酸又能和氢氧化铁反应生成Fe2(SO4)3,故最后得到的即为Fe2(SO4)3,故答案为:Fe2(SO4)3.
点评 本题考查了盐类水解,明确盐的水解规律是解本题关键,注意碳酸氢盐易分解、Mg(HCO3)2易水解生成Mg(OH)2,题目难度不大.


科目:高中化学 来源: 题型:选择题
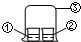 用图中所示的装置进行实验,实验现象与预测不一致的是( )
用图中所示的装置进行实验,实验现象与预测不一致的是( )| ①中的物质 | ②中的物质 | 预测现象 | |
| A | 浓氨水 | FeCl3溶液 | ②中有红褐色沉淀 |
| B | 浓氨水 | 浓盐酸 | ③中有白烟 |
| C | 浓硝酸 | 淀粉KI溶液 | ②中溶液无明显变化 |
| D | 浓盐酸 | 酚酞溶液 | ②中溶液无明显变化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的水溶液能使石蕊试液变红 | B. | 乙酸能与水任意比互溶 | ||
| C. | 乙酸能与Na2CO3溶液反应,产生CO2 | D. | 乙酸钠溶液的PH大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
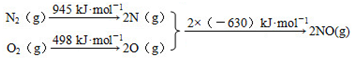

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
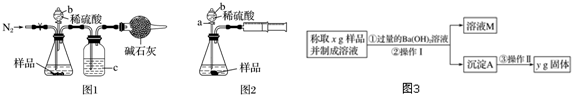
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L乙烯所含共用电子对数为5NA | |
| B. | 72g Ca02所含离子总数为3NA | |
| C. | 常温下,将1mol Cl2通入到过量的NaOH溶液中,电子转移数目为NA | |
| D. | 1L0.1mol/L Na2C03溶液中,C032-数目为0.lNA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com