
[��ѧ��ѡ��2����ѧ�뼼��]
��ˮռ�����ܴ�ˮ����97.2�������Ѻ�ˮ�����ͻ�������������������ܽ����ˮ��Դȱ�������⣬���ܳ�����ú�����Դ��
��ͼ�����ú�ˮ��Դ���л��������IJ��ֹ�������ʾ��ͼ��

��1���ù�������ʾ��ͼ�а����� �� ���ѧ��ҵ�����ƣ���
��2�������̢��У�����ȥ�����к��е�Ca2����Mg2����SO42�������ӣ��轫�����ܽ��˳�����ҩƷ���г��������˵ȡ�����ҩƷ�Ͳ�����˳������� ������ĸ����
A��Na2CO3��NaOH�� BaCl2�����ˡ�����
B��NaOH�� BaCl2�� Na2CO3�����ˡ�����
C��NaOH�� Na2CO3�� BaCl2�����ˡ�����
D��BaCl2��Na2CO3�� NaOH�� ���ˡ�����
��3�����̢��У�ͨ�翪ʼ�������������������� (�ѧʽ)������������ҺpH�� �����������С�����䡱����
��4�����̢��У�ͨ����Ӧ��ѧ��Ӧ���Եõ�NaHCO3���塣��ͼΪNaCl��NH4Cl��NaHCO3��NH4HCO3���ܽ�����ߣ������ܱ�ʾNaHCO3�ܽ�����ߵ��� ������NaHCO3����Ļ�ѧ��Ӧ����ʽ�� ��

��5�����̢��У����ô�������������������ʣ����õ��ᴿ������ �������ƣ���ͨ���÷��ᴿ��õ�������Na2CO3��10H2O��Na2CO3��10H2O��ˮ�õ���ˮ̼���ơ�
��֪��Na2CO3��H2O(s)=Na2CO3(s)+H2O(g) ��H1=+58.73kJ��mol-1
Na2CO3��10H2O(s)=Na2CO3��H2O(s)+9H2O(g) ��H2=+473.63 kJ��mol-1
����ˮ���̲�������̬ˮ��ȫҺ���ͷŵ�����ȫ����������Na2CO3������ܺģ�������������ʧ����������1molNa2CO3��Ҫ����92.36kJ���ɴ˵ó���H2O(g��= H2O(l) ��H= ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�ʡ�߶��Ͽ�ѧ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
���б�ʾ��Ӧ��ѧ��Ӧ�����ӷ���ʽ��ȷ����( )
A��Na2O2����ˮ����O2�� Na2O2+H2O=2Na++2OH-+O2��
B��Fe(OH)3��������Fe(OH)3+3H+=Fe3++3H2O
C�����������Һ��ͨ�����������̼��Ca2++2ClO-+H2O+CO2=CaCO3��+2HClO
D����һ������AlƬͶ��������NaOH��Һ�У�Al3++2OH-+2H2O=2AlO2-+3H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶��Ͽ�ѧ�⻯ѧ�Ծ��������棩 ���ͣ�ʵ����
ijʵ��С��������װ�ý����Ҵ���������ʵ�飮

��1��ʵ�������ͭ�����ֺ�ɫ�ͺ�ɫ�����������д�����кڱ������Ӧ�Ļ�ѧ����ʽ�� __________________���ڲ��Ϲ������������£�Ϩ��ƾ��ƣ���Ӧ���ܼ������У�˵�����Ҵ���������Ӧ��________��Ӧ��
��2�����������ձ��зֱ�ʢ������ˮ�ͱ�ˮ�������÷ֱ��ǣ�����________������________��
��3����Ӧ����һ��ʱ�����ƿ���ռ������������Ҫ�ɷ���________��
��4�����Թ�a���ռ�����Һ������ɫʯ����ֽ���飬��ֽ�Ժ�ɫ��Ҫ��ȥ�����ʣ������ڻ��Һ�м���________(��д��ĸ)��
a��̼��������Һ b���� c���Ȼ�����Һ d�����Ȼ�̼
Ȼ����ͨ��________(��ʵ���������)���ɳ�ȥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶��ϵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���±�Ϊ��ȡCu2O�����ַ�����

��1����֪��2Cu (s)+½O2(g) =Cu2O(s) ��H=-a kJ��mol-1
C (s)+½O2(g) =CO (g) ��H=-b kJ��mol-1
Cu (s)+½O2(g) =CuO (s) ��H=-c kJ��mol-1
��I�����ķ�Ӧ��2CuO(s) +C(s) =Cu2O(s)+CO(g)����H__________kJ��mol-1
��2����ҵ�Ϻ����÷���I��ȡCu2O�������ڷ���I��Ӧ���������ƣ������²������ή��Cu2O���ʣ������ԭ��__________________��
��3������IIΪ������������Һ̬��(N2H4)��ԭ����Cu (OH)2���Ʊ�����Cu2O��ͬʱ�ų�N2�����Ʒ��Ļ�ѧ����ʽΪ____________________��
(4)����III�������ӽ���Ĥ���Ƶ��Һ��OH-��Ũ�ȶ��Ʊ�����Cu2O��װ����ͼ��ʾ��д���缫��Ӧʽ��˵����װ���Ʊ�Cu2O��ԭ��________________________��
��5������ͬ���ܱ������У����������ַ����Ƶõ�Cu2O�ֱ���д��ֽ�ˮ��ʵ�飺
2H2O(g) 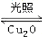 2H2(g) + O2(g) ��H>O��ˮ������Ũ��(mol/L)��ʱ��t(min)�仯���±���ʾ
2H2(g) + O2(g) ��H>O��ˮ������Ũ��(mol/L)��ʱ��t(min)�仯���±���ʾ
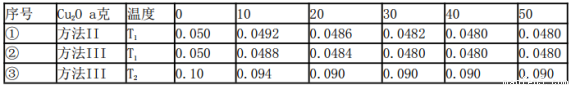
����������ȷ����_________������ĸ���ţ���
a��ʵ����¶ȣ�T2<T1
b��ʵ���ǰ20min��ƽ����Ӧ����v(O2)=7��10- 5mol/(L��min)
c��ʵ��ڱ�ʵ������õ�Cu2O��Ч�ʸ�
d��ʵ��١��ڡ��۵Ļ�ѧƽ�ⳣ���Ĺ�ϵ��K1=K2<K3

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶��ϵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪����CH3OH(g) +3/2O2(g)=CO2(g)+2H2O(g) ��H=-a kJ��mol-l
��CH4(g) +2O2 (g) =CO2 (g) +2H2O(g) ��H=-b kJ��mol-l
��CH4(g) +2O2 (g) =CO2 (g) +2H2O(1) ��H=-c kJ��mol-l
������������ȷ����
A���������Ȼ�ѧ����ʽ��֪b>c
B�������ȼ����ΪbkJ/mol
C.2CH3OH (g) =2CH4(g)+O2(g) ��H=2(b-a) kJ��mol-l
D�����״��ͼ������ʵ���֮��Ϊ1��2ʱ������ȫȼ������CO2��H2O (1)ʱ���ų�������ΪQ kJ����û�����м״������ʵ���ΪQ/(a+2b) mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������ʡ������һ������ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪CH3COOH��NH3��H2O�ĵ����ǿ���̶��൱�������£���ϡ������Һ�м���һ������ij���ʺ���ˮ�������c(H��)��1.0��10-7mol��L-1�����������ʿ�����
A��NaCl B��NaHSO4 C��CH3COONa D��CH3COONH4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ������ѧ�������Ի�ѧ�Ծ��������棩 ���ͣ������
���úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״�����Ҫ��Ӧ���£�
��CO(g)+2H2(g) CH3OH(g) ��H=��99kJ��mol��1
CH3OH(g) ��H=��99kJ��mol��1
��CO2(g)+3H2(g) CH3OH(g)+H2O(g) ��H=��58 kJ��mol��1
CH3OH(g)+H2O(g) ��H=��58 kJ��mol��1
��CO2(g)+H2(g) CO(g)+H2O(g) ��H
CO(g)+H2O(g) ��H
��1����Ӧ�ٵĻ�ѧƽ�ⳣ��K�ı���ʽΪ ��ͼ1������ȷ��ӳƽ�ⳣ��K���¶ȱ仯��ϵ�������� ����Ӧ�۵ġ�H= kJ��mol��1��

��2���ϳ��������n(H2)/n(CO+CO2)=2.60ʱ��ϵ�е�COƽ��ת���ʦ�(CO)���¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ2��ʾ��ͼ�е�ѹǿp1��p2��p3�ɴ�С��˳��Ϊ ����(CO)���¶����߶���С����ԭ���� ��
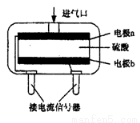
��3��Ϊ��ȫ�������ҵ��������Կ����е�CO���м�⡣
�ٷۺ�ɫ��PdCl2��Һ���Լ�������������CO���������к�CO������Һ�л������ɫ��Pd������ÿ����5.3gPd��������Ӧ��ת�Ƶĵ�����Ϊ ��
��ʹ�õ绯ѧCO���崫����������������CO��������ģ����ͼ��ʾ�����ִ�����������ԭ���ԭ������õ�صĸ�����ӦʽΪ ��
��4��CO��Fe��һ�������¿��γ����ʻ���[Fe(CO)5]���û�����������H2�����⻯�ʻ������⻯�ʻ���Ϊ��Ԫ���ᣬ����NaOH��Ӧ�������ʻ�������ơ����ʻ�������H2�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ������ѧ�������Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й����ʵ���������;���ж�Ӧ��ϵ����
A����������ˮ���γ������������壬����������ˮ��ɱ������
B�������û����������е����������ڸ�����ҵ�д���ұ����
C��̼���ƾ��м��ԣ�������θ���кͼ�
D������þ�۵�ߣ����������²���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��㶫ʡ��ͷ�и߶���ѧ����ѧ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���л��к��ߵ������ڷ�Ӧ�в�����ȫ���ĵ���
A����������CO2��CO����ͨ��ʢ������Na2O2���ܱ������У��������õ����ȼ
B����l mol Mg����10 L������������У�ʹ֮�ڸ����·�Ӧ
C����״���£���11.2L H2S��22.4L O2��ϵ�ȼ
D����ǿ����������£��������Ca(ClO)2������Һ��ͨ������CO2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com