
| A. | 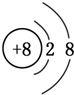 | B. | 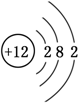 | C. | 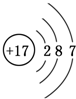 | D. | 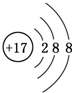 |
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:多选题
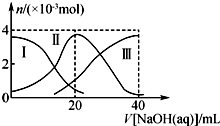 常温下,向20mL 0.2mol•L-1H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如右图(Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).下列说法正确的是( )
常温下,向20mL 0.2mol•L-1H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如右图(Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).下列说法正确的是( )| A. | H2A在水中的电离方程式为H2A═H++HA-,HA-?H++A2- | |
| B. | 向NaHA溶液中加水,HA-的电离度增大、溶液的pH减小 | |
| C. | V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | V(NaOH)=30 mL时,溶液中存在如下关系:2c(H+)-2c(OH-)=c(A2-)-3c(H2A)-c(HA-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | V(Na2S2O3)/mL | c(H2SO4)/mol•L-1 | V(H2SO4)/mL | V(H2O)/mL |
| ① | 25 | 0.1 | 5.0 | 0.1 | 10.0 | a |
| ② | 25 | 0.1 | 10.0 | 0.1 | 10.0 | 0 |
| ③ | 25 | 0.2 | 5.0 | 0.1 | 5.0 | b |
| ④ | 50 | 0.2 | 5.0 | 0.1 | 10.0 | 5.0 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①③⑥ | C. | ①②⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲分子中氢的质量分数为40% | |
| B. | 甲和由甲生成的羧酸与醇三者均可溶于水 | |
| C. | 甲在常温常压下为无色液体 | |
| D. | 乙和甲的最简式不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是离子化合物 | B. | 加热时,它很稳定,不发生分解 | ||
| C. | 它能跟碱发生反应 | D. | 它可由PH3和HI化合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通人CH4的电极为负极 | |
| B. | 正极发生氧化反应 | |
| C. | 燃料电池工作时,溶液中的OH-向负极移动 | |
| D. | 该电池使用一段时间后应补充KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 含有极性键的分子一定是极性分子 | |
| D. | 含有共价键的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com