
已知某物质X能发生如下转化:
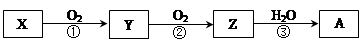
下列有关上述转化关系中物质及其反应的叙述错误的是
A若X??N2或NH3(催化氧化),则A为硝酸
B若X为S 或H2S(完全燃烧),则A为硫酸
C若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
D反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源:2014高考名师推荐化学三类分散系及比较(解析版) 题型:选择题
氯化铁溶液与氢氧化铁胶体具有的共同性质是
A.分散质颗粒直径都在1~100 nm之间
B.加热蒸干、灼烧后都有氧化铁生成
C.呈红褐色
D.能透过半透膜
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学Ksp概念及简单应用(解析版) 题型:填空题
某化学兴趣小组利用某废弃的氧化铜锌矿制取活性ZnO实验流程如下:
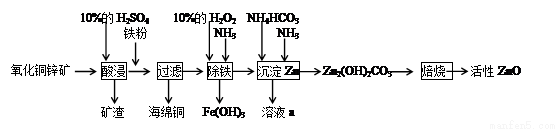
请回答下列问题:
(1)加入铁粉后发生反应的离子方程式为__________。
(2)甲、乙两同学选用下列仪器,采用不同的方法来制取氨气。
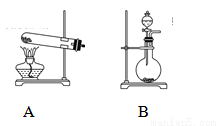
①甲同学使用的药品是熟石灰与氯化铵,则应选用装置______(填写装置代号),生成氨气的化学方程式为____________;
②乙同学选用了装置B,则使用的两种药品的名称为_______________。
(3)H2O2的作用是_____________。
(4)除铁过程中得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂(K2FeO4),该反应中氧化剂与还原剂的物质的量之比为____________。
(5)乙知溶液a中含有CO32-、SO42-两种酸根阴离子,若只允许取用一次样品,检验这种离子存在的实验操作过程为___________________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学CB计算法(解析版) 题型:选择题
在80 g密度为d g·cm-3的硫酸铁溶液中,含有2.8 g Fe3+,则此溶液中SO42-的物质的量浓度(mol·L-1)为
A.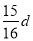 B.
B.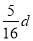 C.
C.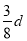 D.
D.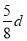
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:简答题
【化学与技术】
工业上以氨气为原料制备硝酸的过程如图1所示:
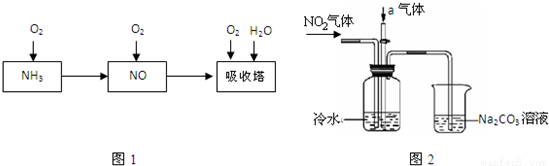
某课外小组模拟上述部分过程设计了如图2所示实验装置制备硝酸(所有橡胶制品均已被保护)
(1)工业上用氨气制取NO的化学方程式是 ;
(2)连接好装置后,首先进行的操作是 ;
(3)通入a气体的目的是 ;
(4)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中发生反应的化学方程式是 。
(5)已知:温度低于21.15℃时,NO2几乎全部转变为N2O4,工业上可用N2O4与水反应来提高硝酸产率,N2O4与a气体在冷水中生成硝酸的化学方程式是 ;
(6)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.500mol/L,c(N2O4)=0.125mol/L.则2NO2(g) N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。
N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:简答题
2012年8月24日,武汉市一家有色金属制造厂发生氨气泄露事故。已知在一定温度下,合成氨工业原料气H2制备涉及下面的两个反应:
C(s)+H2O(g) CO(g)+H2(g);
CO(g)+H2(g);
CO(g)+H2O(g) H2(g)+CO2(g)。
H2(g)+CO2(g)。
(1)判断反应CO(g)+H2O(g) CO2(g)+H2(g)达到化学平衡状态的依据是________。(多选、漏选、错选均不得分)
CO2(g)+H2(g)达到化学平衡状态的依据是________。(多选、漏选、错选均不得分)
A.容器内压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(2)在2 L定容密闭容器中通入1 mol N2(g)和3 mol H2(g),发生反应:3H2(g)+N2(g)  2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
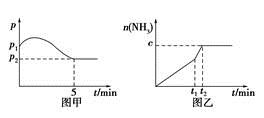
①若图中c=1.6 mol,则改变的条件是________(填字母);
②若图中c<1.6 mol,则改变的条件是__________(填字母);此时该反应的平衡常数____________。(填字母)(填“增大”、“减小”、“不变”)
A.升温 B.降温 C.加压 D.减压 E.加催化剂
(3)如(2)题中图甲,平衡时氢气的转化率为________。
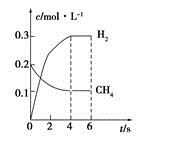
(4)工业上可利用如下反应:H2O (g)+CH4 (g)  CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。
CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:选择题
用表示阿伏加德罗常数的数值,下列说法正确的是
A.1 mol Na2O2晶体中共含有个离子
B.0.1 molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒
C.常温常压下,和混合气体含有个氧原子
D.电解法冶炼铝时每转移个电子,阳极生成氧气
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:选择题
现有等物质的量的铜和银的混合物17.2克,与50.0mL的浓硝酸恰好完全反应,产生气体4.48L(标准状况),则下列说法正确的是
A.产生的气体是0.2molNO2
B.硝酸的物质的量浓度为12mol/L
C.反应中被还原和未被还原的硝酸物质的量之比为3:2
D.要使产生的气体恰好完全被水吸收需要通入氧气0.075mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com