
【题目】Cu2O是一种几乎不溶于水的氧化物,在涂料、玻璃等领域应用非常广泛。一种以硫化铜矿石(含CuFeS2、Cu2S 等) 为原料制取Cu2O 的工艺流程如下:
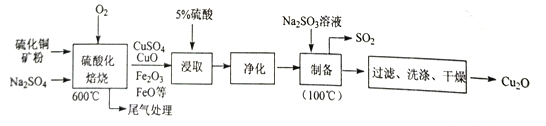
(1)“硫酸化焙烧”时:①硫化铜矿需粉碎的目的是_________;②CuS 与O2反应生成CuSO4等物质的化学方程式为________;③加入Na2SO4的作用除减小物料间黏结外,另一主要作用是__________。
(2)“浸取”时为提高铜的浸取率,除需控制硫酸的浓度外,还需控制_________ (至少列举两点)。
(3)“制备”时,溶液的pH与Cu2O 的产率关系如右图所示。
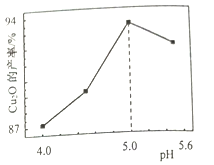
①在100℃时,发生反应的离子方程式为__________
②图中在4<pH<5 时,pH越小产率越低且产品中杂质Cu的含量越高,是因为________。
【答案】 提高硫化铜矿的利用率 2Cu2S+5O2![]() 2CuSO4+2CuO 提高焙烧产物中CuSO4比例 浸取温度、浸取时间、液固物质的量之比、焙烧产物颗粒的直径等 2Cu2++3SO32-
2CuSO4+2CuO 提高焙烧产物中CuSO4比例 浸取温度、浸取时间、液固物质的量之比、焙烧产物颗粒的直径等 2Cu2++3SO32-![]() Cu2O↓+SO42-+2SO2↑ pH越小时Cu2O越易与H+发生反应,生成Cu和Cu2+
Cu2O↓+SO42-+2SO2↑ pH越小时Cu2O越易与H+发生反应,生成Cu和Cu2+
【解析】(1)“硫酸化焙烧”时:①硫化铜矿需粉碎的目的是增大接触面积,提高硫化铜矿的利用率;②CuS 与O2反应生成CuSO4等物质的化学方程式为 2Cu2S+5O2![]() 2CuSO4+2CuO;③加入Na2SO4的作用除减小物料间黏结外,另一主要作用是增大SO42-浓度,提高焙烧产物中CuSO4比例;(2)“浸取”时为提高铜的浸取率,除需控制硫酸的浓度外,还需控制 浸取温度、浸取时间、液固物质的量之比、焙烧产物颗粒的直径等;(3)①在100℃时,Cu2+还原成Cu2O,SO32-氧化成SO42-,发生反应的离子方程式为 2Cu2++3SO32-
2CuSO4+2CuO;③加入Na2SO4的作用除减小物料间黏结外,另一主要作用是增大SO42-浓度,提高焙烧产物中CuSO4比例;(2)“浸取”时为提高铜的浸取率,除需控制硫酸的浓度外,还需控制 浸取温度、浸取时间、液固物质的量之比、焙烧产物颗粒的直径等;(3)①在100℃时,Cu2+还原成Cu2O,SO32-氧化成SO42-,发生反应的离子方程式为 2Cu2++3SO32-![]() Cu2O↓+SO42-+2SO2↑ ;②图中在4<pH<5 时,pH越小产率越低且产品中杂质Cu的含量越高,是因为pH越小时Cu2O越易与H+发生反应,生成Cu和Cu2+。
Cu2O↓+SO42-+2SO2↑ ;②图中在4<pH<5 时,pH越小产率越低且产品中杂质Cu的含量越高,是因为pH越小时Cu2O越易与H+发生反应,生成Cu和Cu2+。


科目:高中化学 来源: 题型:
【题目】25C时,氯水中部分含氯的物种的分布分数(平衡时某物种的浓度占各物种浓度之和的百分數) 与pH的关系如下图所示。

下列叙述正确的是
A. 新制的pH=1的氯水中,c(C13-)>c(HClO)>c(H+)
B. 新制氯水中持续通入SO2,pH不断变小,溶液颜色不断加深
C. 25℃时,HClO![]() H++ClO-的电离常数Ka的对数值为lgKa=-7.54
H++ClO-的电离常数Ka的对数值为lgKa=-7.54
D. pH=6的氯水中加入NaOH溶液,主要发生的离子反应方程式为HClO+OH-=ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2·12H2O (铵明矾) 可用作泡沫灭火器的内留剂、石油脱色剂等。用氧化铁和铝粉等物质做铝热反应后的铝灰及硫酸铵等为原料制备铵明矾的实验步骤如下:
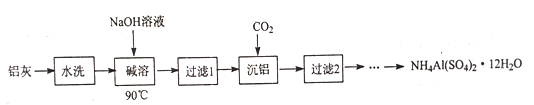
(1) 铝灰用“水洗”的目的是______碱溶时,需在约90℃条件下进行,适宜的加热方式为_____。
(2)“过滤1”所得滤渣主要成分为_________。
(3)用下图左边装置制备CO2时,适宜的药品A 为________、B 为__________;“沉铝”时,通入过量CO2 发生反应的离子方程式为________。
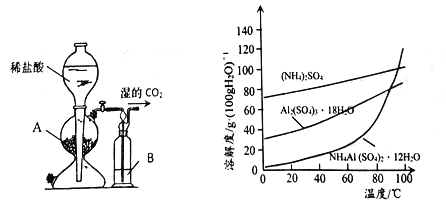
(4)请设计从“过滤2”所得滤渣制取铵明矾的实验方案: 称取一定质量“过滤2”的滤渣,放入烧杯中,____,静置,过滤、洗涤、晾干,得到NH4Al(SO4)2·12H2O [实验中须使用到3mol/L硫酸、(NH4)2SO4、蒸馏水、氨水、pH 试纸; 已知: NH4Al(SO4)2饱和溶液的pH约为1.5,几种物质的溶解度曲线见右上图]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】性能各异的各种材料的广泛应用大大提高了人们的生活水平。回答问题:
(1)家庭中“钢精锅”是由铝合金做成的,在烧菜时能否放大量醋炖煮?______。(填能或否)
(2)下列关于铁制品保护措施的说法中不正确的有___________(填序号)
A.在自行车钢圈上镀上一层金属铬,摩擦部位加上润滑油
B.相同条件下,镀层破损时,马口铁(表层镀锡)比白铁(表层镀锌)更耐用
C.在海轮的外壳上常焊有锌块,且定期更新
D.将不锈钢制成刀具和餐具,有的刀具还需进行烤蓝处理
(3)硅酸盐产品在生活中使用广泛,下列不是硅酸盐产品的是_______________。
A.水泥 B.陶瓷 C.玻璃 D.塑料
(4)钢筋混凝土是重要的建筑材料,钢筋混凝土______ (填“是”或“不是”)复合材料。
(5)生产玻璃时,石灰石与石英反应的化学方程式为______________________________。
(6)SiC是一种新型陶瓷,工业上用石英砂与焦炭高温条件下生成SiC的同时生成CO,该反应的化学方程式_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
A. 加入水时,平衡逆向移动
B. 加入少量NaOH固体,平衡正向移动
C. 加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变
D. 加入少量CH3COONa固体,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C均为短周期元素,它们在周期表中的位置如图所示.已知:B,C两元素原子最外层电子数之和等于A元素原子最外层电子数的2倍;B,C两元素的核电荷数之和是A元素原子序数的4倍.则A,B,C分别是( ) 
A.C,Al、P
B.N,Si、S
C.O,P,Cl
D.F,S,Ar
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com