

| 放电 |
| 充电 |
| 放电 |
| 充电 |
| 放电 |
| 充电 |
| 放电 |
| 充电 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
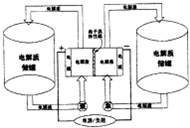 下图是一种正在投入生产的大型蓄电系统.左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2和NaIX(3≤x≤5),放电后,分别变为Na2S4和NaI.则下列说法不正确的是( )
下图是一种正在投入生产的大型蓄电系统.左右两侧为电解质储罐,中央为电池,电解质通过泵不断在储罐和电池间循环;电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;放电前,被膜隔开的电解质为Na2S2和NaIX(3≤x≤5),放电后,分别变为Na2S4和NaI.则下列说法不正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
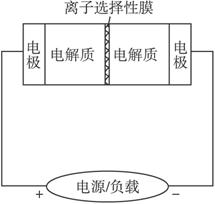
A.充电的过程中当0.1 mol Na+通过离子交换膜时,导线通过0.1 mol电子
B.电池放电时,负极反应为:3NaBr-2e-====NaBr3+2Na+
C.充电过程中钠离子从右到左通过离子交换膜
D.放电过程中钠离子从右到左通过离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
(9分)由硫可制得多硫化钠Na2Sx,x的值一般为2~6。当x=2时,多硫化钠称为过硫化钠。
Ⅰ.过硫化钠加入盐酸中有硫沉淀析出,写出该反应的化学方程式 ,该反应的还原产物是 。
Ⅱ.某些多硫化钠可用于制作蓄电池。下图是一种正在投入生产的大型蓄电系统的原理图。
电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过。电池充、放电的化学反应方程式为:
![]()
(1)电池中的左侧“电极”的电极名称是 (填“正极”或“负极”)。
(2)放电过程中钠离子从 (选“左到右”或“右到左”)通过离子交换膜。
(3)写出充电过程中阳极的电极反应式 。
查看答案和解析>>
科目:高中化学 来源:2010年海南省海口市高三下学期高考调研(一)化学试题 题型:填空题
(9分)由硫可制得多硫化钠Na2Sx,x的值一般为2~6。当x=2时,多硫化钠称为过硫化钠。
Ⅰ.过硫化钠加入盐酸中有硫沉淀析出,写出该反应的化学方程式 ,该反应的还原产物是 。
Ⅱ.某些多硫化钠可用于制作蓄电池。下图是一种正在投入生产的大型蓄电系统的原理图。
电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过。电池充、放电的化学反应方程式为:



(1)电池中的左侧“电极”的电极名称是 (填“正极”或“负极”)。
(2)放电过程中钠离子从 (选“左到右”或“右到左”)通过离子交换膜。
(3)写出充电过程中阳极的电极反应式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com