
(一)选择方案
方案Ⅰ:用废铜屑与热的浓硫酸反应,生成CuSO4后,蒸发溶液制得CuSO4·5H2O晶体。化学方程式:
Cu+2H2SO4(浓)![]() CuSO4+ SO2↑+2H2O
CuSO4+ SO2↑+2H2O
方案Ⅱ:把废铜屑在空气中加热氧化,再把CuO放入稀硫酸中溶解得到CuSO4,蒸发溶液制得CuSO4·5H2O晶体。化学方程式:
2Cu+O2![]() 2CuO
2CuO
CuO+H2SO4====CuSO4+H2O
方案Ⅲ:把废铜屑放入热的稀硫酸中并连续通入O2,生成CuSO4,蒸发溶液制得CuSO4·5H2O晶体。总反应的化学方程式:
2Cu+O2+2H2SO4![]() 2CuSO4+2H2O
2CuSO4+2H2O
(二)实验方案的评价
方案Ⅰ的缺点是浪费原料(硫酸),且容易导致环境污染。方案Ⅱ比方案Ⅰ要好,但铜屑加热氧化时,要做到铜的内部充分氧化是困难的。相比之下,方案Ⅲ克服了前两个方案的缺点,具有加热温度低,原料利用率高,操作简单等优点。
(三)实验方案的设计
实验名称:用废铜屑为原料制备CuSO4·5H2O晶体。
实验目的:1.进一步巩固对铜的有关化学性质的理解;
2.学会重结晶法制备有关物质的方法,学会热过滤等基本操作;
3.进一步巩固物质制备实验设计的一般方法的掌握。
实验用品:烧杯、量筒、玻璃棒、天平、酒精灯、过滤器、火柴、废铜屑、稀硫酸、NaOH溶液、蒸馏水。
实验步骤:先用热碱液除去废铜屑表面的油污,用蒸馏水冲洗净后烘干,称其质量(m1),然后进行如下操作:
(1)在烧杯中倒入40 mL稀硫酸,加入足量废铜屑,以使稀硫酸浸没所有铜屑为度。小心加热,并持续通入空气,这时可以看到溶液逐渐变成蓝色,直至铜屑反应完全。
(2)用少量热水通过过滤器,以提高它的温度,然后将溶液趁热过滤,将滤液转入蒸发皿中,小心加热至有晶体析出后停止加热,静置、冷却、结晶,观察滤液冷却生成蓝色的CuSO4晶体的现象。
(3)待晶体结晶完毕后,取出晶体,用少量蒸馏水洗涤2—3次,再用滤纸将晶体吸干。
(4)称量CuSO4·5H2O晶体的质量(m2),计算产率。
(5)把制得的CuSO4·5H2O晶体放在一个小广口瓶中,密闭保存。
实验现象记录及实验结果处理
实验现象:
实验结果处理:
铜屑的质量(m1) |
|
CuSO4·5H2O的实际质量(m2) |
|
CuSO4·5H2O的理论质量(m3) |
|
产率计算公式 |
|
本实验CuSO4·5H2O的产率 |
|


科目:高中化学 来源: 题型:
| 高温 |
| 高温 |
| 高温 |
| (a-b) |
| 2 |
| (a-b) |
| 2 |
 HS-+OH-
HS-+OH- HS-+OH-
HS-+OH-| O | 2- 3 |
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,可以简写为
,可以简写为 )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:


 )与Br2为主要起始物质,通过加成、消去两步反应制得.写出由苯乙烯制取苯乙炔的两步化学方程式(其他试剂自选).
)与Br2为主要起始物质,通过加成、消去两步反应制得.写出由苯乙烯制取苯乙炔的两步化学方程式(其他试剂自选).



查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
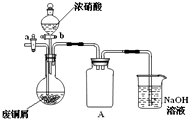 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
A.Cu+浓HNO3
B.Cu+稀HNO3
C.Cu+AgNO3
D.![]()
其中最好的是_______.理由是_____________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com