
| A. | 溶液中存在CO32- | B. | 溶液中c(Na+)>c(CO32-) | ||
| C. | 与等物质的量的NaOH恰好中和 | D. | 溶液中c(H+)•c(OH-)=10-14 |
分析 弱酸属于弱电解质,在溶液中部分电离,存在电离平衡,据此分析.
解答 解:A.溶液中存在CO32-,说明NaHCO3发生电离,但不一定是部分电离,所以不能证明H2CO3为弱酸,故A错误;
B.溶液中c(Na+)>c(CO32-),说明HCO3-的电离为部分电离,所以能够证明H2CO3为弱酸,故B正确;
C.与等物质的量的NaOH恰好中和,说明NaHCO3能电离出氢离子,但不一定是部分电离,所以不能证明H2CO3为弱酸,故C错误;
D.25℃的溶液中均存在c(H+)•c(OH-)=10-14,与H2CO3的酸性强弱无关,故D错误.
故选B.
点评 本题考查了弱电解质的电离,题目难度不大,注意把握弱电解质在溶液中部分电离的特点.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:解答题
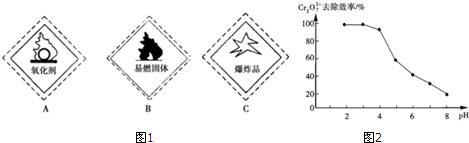
 Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.
Cr2O72-+H2O,pH小,c(H+)浓度大,平衡正移,使测定结果不准确.| 金属离子 | Ksp | pH(10-1 mol•L-1) | pH(10-5 mol•L-1) |
| Fe3+ | 4.0×10-38 | 2.7 | 3.7 |
| Cr3+ | 6.0×10-31 | 4.3 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO32-中硫原子的杂化方式为sp3 | B. | H2O分子中氧原子的杂化方式为sp2 | ||
| C. | BF3分子呈三角锥体空间型 | D. | C2H2分子中含有3个σ键和2个π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
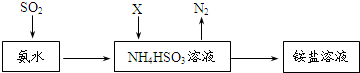
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
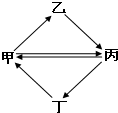 下列各组物质按如图所示转化关系每一步都能一步实现的是
下列各组物质按如图所示转化关系每一步都能一步实现的是| 甲 | 乙 | 丙 | 丁 | |
| A | FeCl3 | FeCl2 | Fe2O3 | Fe(OH)3 |
| B | Cu | CuO | CuSO4 | CuCl2 |
| C | C | CO | CO2 | H2CO3 |
| D | NH3 | NO | NO2 | HNO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
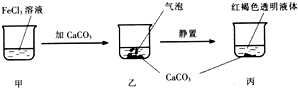
| A. | 乙中产生的气泡是C02 | |
| B. | 丙中液体可产生丁达尔现象 | |
| C. | 若忽略溶液体积的变化,烧杯中c(Cl-)不发生变化 | |
| D. | 若将CaC03换成CaS04也可得到相同的实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A | B | C | D | |
| 操作与现象 | 放在石棉网上的钠在空气中燃烧生成黑色固体 | 铜与稀硝酸反应试管内产生红棕色气体 | 0.5mol/L的CaCl2滴入0.5mol/L的NaHCO3中产生白色沉淀 | Cu与浓硫酸反应生成白色及少量黑色沉淀物 |
| 解释 | 生成固体物质有大量的碳 | 反应产生的NO与试管内的空气反应 | 反应2HCO3-+Ca2+=CaCO3↓+H2O+CO2↑ | 白色沉淀是CuSO4黑色沉淀是Cu2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸汽和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| C. | 由C(金刚石)═C(石墨)△H=-1.9 kJ•mol-1可知,金刚石比石墨稳定 | |
| D. | NH3的稳定性强,是因为其分子之间存在氢键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com