
1919年,Langmuir提出等电子体的概念,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体。等电子体的结构相似、物理性质相近。根据上述原理,下列各对粒子中,空间构型相似的是( )
A.SO2和O3 B.CO2和NO2
C.CS2和NO2 D.PCl3和BF3
 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
金属键的形成是通过( )
A.金属原子与自由电子之间的相互作用
B.金属离子与自由电子之间强烈的相互作用
C.自由电子之间的相互作用
D.金属离子之间的相互作用
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C三种晶体,分别由H、C、Na、Cl 4种元素的一种或几种形成,对这3
种晶体进行实验,结果如下表。
| 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与 Ag+反应 | |
| A | 811 | 较大 | 易溶 | 水溶液或熔融导电 | 白色沉淀 |
| B | 3 550 | 很大 | 不溶 | 不导电 | 不反应 |
| C | -114.2 | 很小 | 易溶 | 液态不导电 | 白色沉淀 |
(1)晶体的化学式分别为:
A____________;B____________;C____________。
(2)晶体的类型分别为:
A____________;B____________;C____________。
(3)晶体中粒子间的作用力分别为:
A____________;B____________;C____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
试回答下列问题:
(1)指出下面物质分子或离子的空间构型:PO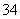 ___________________;
___________________;
CS2_______________。
(2)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:

A:______________;B:____________。
(3)按要求写出第2周期非金属元素构成的中性分子的化学式:
平面形分子____________,三角锥形分子________________,四面体形分子
____________。
(4)下列一组微粒中键角由大到小顺序排列为______________(用编号填写)。
①HCN ②SiF4 ③SCl2 ④CO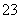 ⑤H3O+
⑤H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于苯分子的结构与性质的描述错误的是( )
A.苯分子呈平面正六边形,六个碳碳键完全相同,键角皆为120°
B.苯分子中C原子采取sp2杂化,六个碳原子中未参与杂化的2p轨道以“肩并肩”的方式形成一个大π键
C.苯分子中的碳碳双键是介于单键和双键之间的一种特殊类型的键
D.苯能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
普通玻璃和水晶的根本区别在于( )
A.外形不一样
B.普通玻璃的基本构成微粒无规则性地排列,水晶的基本构成微粒按一定规律做周期性重复排列
C.水晶有固定的熔点,普通玻璃无固定的熔点
D.水晶可用于能量转换,普通玻璃不能用于能量转换
查看答案和解析>>
科目:高中化学 来源: 题型:
水的状态除了气、液和固态外,还有玻璃态,它是由液态水急速冷却到165 K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同。有关玻璃态水的叙述正确的是( )
A.水由液态变为玻璃态,体积缩小
B.水由液态变为玻璃态,体积膨胀
C.玻璃态是水的一种特殊状态
D.玻璃态水是分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.含有离子键的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
B.0.1 mol丙烯酸中含有双键的数目为0.1NA
C.标准状况下,11.2 L苯中含有分子的数目为0.5NA
D.在过氧化钠与水的反应中,每生成0.1 mol氧气,转移电子的数目为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com