
【题目】某有机物的结构简式为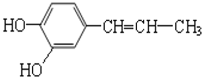 ,请回答问题:
,请回答问题:
(1)此物质是否属于烃?_______(填“是”或者“否”);
(2)此物质的分子式是__________;
(3)此物质中苯环的结构特点________________;
(4)请写出此物质可能具有的一种化学性质________________(写出一种即可)。
【答案】否 C9H10O2 平面六边形,苯环中的碳碳键是介于碳碳单键和碳碳双键之间的特殊的化学键 加成反应或取代反应或氧化反应或加聚反应
【解析】
由结构简式可知,该有机物的分子式为C9H10O2,含有的官能团为酚羟基和碳碳双键,能表现烯烃和酚的性质,能发生取代反应或加成反应或氧化反应或加聚反应等。
(1)烃是仅含有碳元素和氢元素的化合物,由结构简式可知,该有机物含有氧元素,一定不属于烃,故答案为:否;
(2)由结构简式可知,该有机物含有9个碳原子、10个氢原子和2个氧原子,分子式为C9H10O2,故答案为:C9H10O2;
(3)苯是由6个碳原子和6个氢原子形成的平面正六边形,所有原子在同一平面,该有机物中含有苯环,苯环是平面六边形,成键特点是碳碳键是介于碳碳单键和碳碳双键之间的特殊的化学键,故答案为:平面六边形,苯环中的碳碳键是介于碳碳单键和碳碳双键之间的特殊的化学键;
(4)由结构简式可知,该有机物含有的官能团为酚羟基和碳碳双键,能表现烯烃和酚的性质,能发生取代反应或加成反应或氧化反应或加聚反应等,故答案为:加成反应或取代反应或氧化反应或加聚反应。


科目:高中化学 来源: 题型:
【题目】钠、铝是两种重要的金属,其单质及化合物在人们的日常生活、生产及科学研究中具有广泛的用途。回答下列问题:
(1)基态铝原子的电子排布图是____________________。
(2)与Al3+具有相同的电子层结构的简单阴离子有__________(填离子符号),其中形成这些阴离子的元素中,电负性最强的是__________(填元素符号,下同),第一电离能最小的是__________。
(3)Al、Cl的电负性如下表:
元素 | Al | Cl |
电负性 | 1.5 | 3.0 |
则AlCl3为________晶体(填晶体类型);AlCl3升华后蒸气的相对分子质量约为267,则该蒸气分子的结构式是____________(标明配位键)。
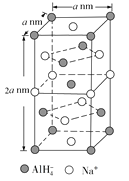
(4)氢化铝钠(NaAlH4)是重要的有机合成中还原剂。
①![]() 的空间构型为____________。
的空间构型为____________。
②NaAlH4的晶胞如下图所示,与Na+紧邻且等距的![]() 有________个;NaAlH4晶体的密度为________g/cm3(用含a 的代数式表示,NA代表阿伏加德罗常数)。
有________个;NaAlH4晶体的密度为________g/cm3(用含a 的代数式表示,NA代表阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应方程式书写错误的是( )
A.![]() +HO-NO2(浓)
+HO-NO2(浓)![]()
![]() +H2O
+H2O
B.CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
C.2CH3CH2OH+O2![]() 2CH3CHO
2CH3CHO
D.CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某分子筛作催化剂,NH3可脱除废气中的NO和NO2,生成两种无毒物质,其反应历程如图所示,下列说法正确的是( )

下列说法正确的是( )
A.反应过程中NO2、NH4+之间的反应是氧化还原反应
B.上述历程的总反应可以为:2NH3+NO+NO2 2N2+3H2O
2N2+3H2O
C.X是HNO2,是还原产物
D.[(NH4)(HNO2)]+是反应过程中的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期中的三种元素X、Y、Z的原子序数依次减小,三种元素原子核外电子层数之和是5,X元素原子的最外层电子数是Y和Z两元素原子的最外层电子数的总和;Y元素原子的最外层电子数是它的电子层数的2倍,且Y元素最高正价与最低负价的绝对值相等,X和Z可以形成XZ3的化合物。请回答:
(1)X、Y、Z三种元素的元素符号分别为X_____,Y_____,Z______;
(2)元素X的原子得电子能力__(填"强于"或"弱于")元素Y的原子,用最简单的实验验证(用化学方程式表示)__
(3)XZ3的电子式是_______;
(4)写出向XZ3的水溶液中通入过量Y的最高价氧化物反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢气是一种未来十分理想的能源。
镧镍合金是一种良好的储氢材料,在一定条件下通过如下反应实现储氢:
LaNi3(s)+3H2(g) ![]() LaNi3H6(s) H<0。 某实验室模拟该过程,向体积一定的密闭容器中充入反应物发生反应。H2的平衡转化率与其初始加入量(n)、反应温度(T)的关系如下左图所示;一定温度(T)下,将a mol的氢气充入体积是1 L的容器内,气体的压强(P)随时间(t)的变化关系如下右图所示:
LaNi3H6(s) H<0。 某实验室模拟该过程,向体积一定的密闭容器中充入反应物发生反应。H2的平衡转化率与其初始加入量(n)、反应温度(T)的关系如下左图所示;一定温度(T)下,将a mol的氢气充入体积是1 L的容器内,气体的压强(P)随时间(t)的变化关系如下右图所示:

①n1、n2、n3的大小关系是_______。
②温度T1下反应的平衡常数是__________(用含a的代数式表示)。
③保持温度不变,在t6时刻将容积压缩至原容积的一半,容器内的压强_________6kPa(填写“大于”或“小于”)。
(2)贮氢合金ThNi5可催化由CO、H2合成CH4等有机化工产品的反应。温度为TK时发生以下反应①![]()
②![]()
③![]()
![]() _______。
_______。
(3)TK时,向一恒压密闭容器中充入等物质的量的CO(g)和H2O(g)发生上述反应②(已排除其他反应干扰),测得CO(g)物质的量分数随时间变化如下表所示:

若初始投入CO为2 mol,恒压容器容积10 L,用H2O(g)表示该反应0-5分钟内的速率v[H2O(g)]=______。6分钟时,仅改变一种条件破坏了平衡,且第9min达到平衡时,CO的物质的量是0.2mol,则改变的外界条件为_________。
(4)温度、压强对反应CO(g)十2H2(g)=CH3OH(g) H=-90. 1 kJ·mol-1中CO转化率的影响如图所示:

①温度在较低范围内,对CO转化率影响的主要因素是____________ (填“温度”或“压强”)。
②由图像可知,温度越低,压强越大,CO转化率越高。但实际生产往往采用300~400 °C和10 MPa的条件,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度
B.当一个可逆反应达到平衡状态时,这个反应的正反应速率和逆反应速率相等
C.可以通过控制反应条件,使2 mol SO2与1 mol O2反应生成2 mol SO3
D.化学反应的限度可以通过改变条件来改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表达不正确的是
A.用稀硝酸洗涤做过银镜反应的试管:Ag+4H++NO3- =Ag++NO↑+2H2O
B.HClO的结构式:H-O-Cl
C.Na2CO3溶液呈碱性的原因:CO32-+ H2O![]() HCO3-+ OH-
HCO3-+ OH-
D.CH4的球棍模型:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com